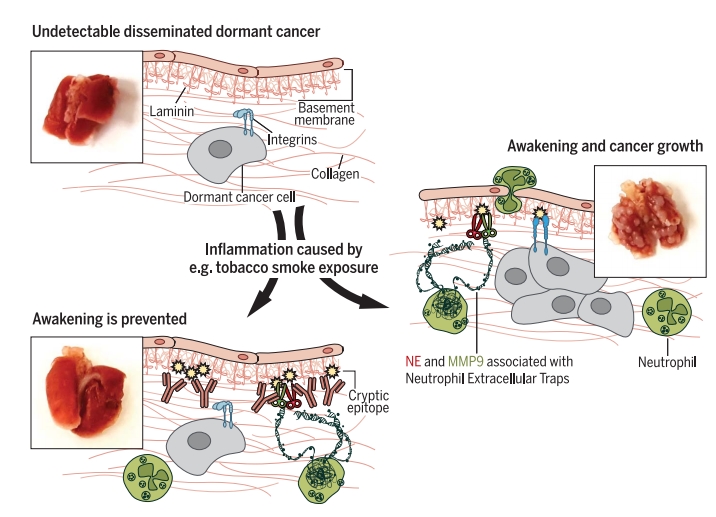
Нейтрофилы, их ловушки, курение и рак


Дейтерий – стабильный изотоп водорода. Водород состоит из 1 протона и 1 электрона, дейтерий же состоит из 1 протона, 1 нейтрона и 1 электрона. Он иногда образуется при взаимодействии двух атомов водорода.
Физические свойства дейтерия и воды с содержанием дейтерия (HDO, D2O) будут несколько отличаться.
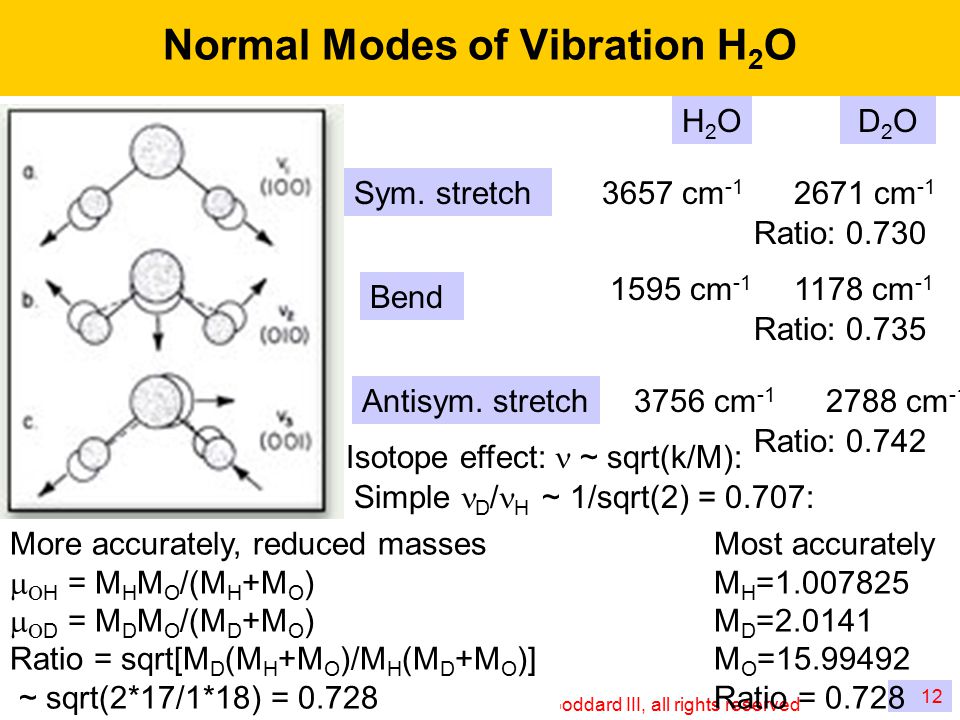
 Дейтерий обладает большей массой и иным спином, чем традиционный водород, поэтому вода, где вместо водорода у нас дейтерий связан с кислородом, будет отличаться по своим физических характеристикам.
Дейтерий обладает большей массой и иным спином, чем традиционный водород, поэтому вода, где вместо водорода у нас дейтерий связан с кислородом, будет отличаться по своим физических характеристикам.
За счёт иных физических параметров дейтерий будет воздействовать на метаболизм всего организма. Обычно это объясняется такими феноменами как кинетический изотопный эффект и химический изотопный эффект.
В частности, дейтерий образовывает более сильные гидрофобные связи, чем водород. Что прекрасно известно в фармацевтической промышленности, где дейтерий используют, например, для увеличения продолжительности действия лекарства (пример – мнн deutetrabenazine).
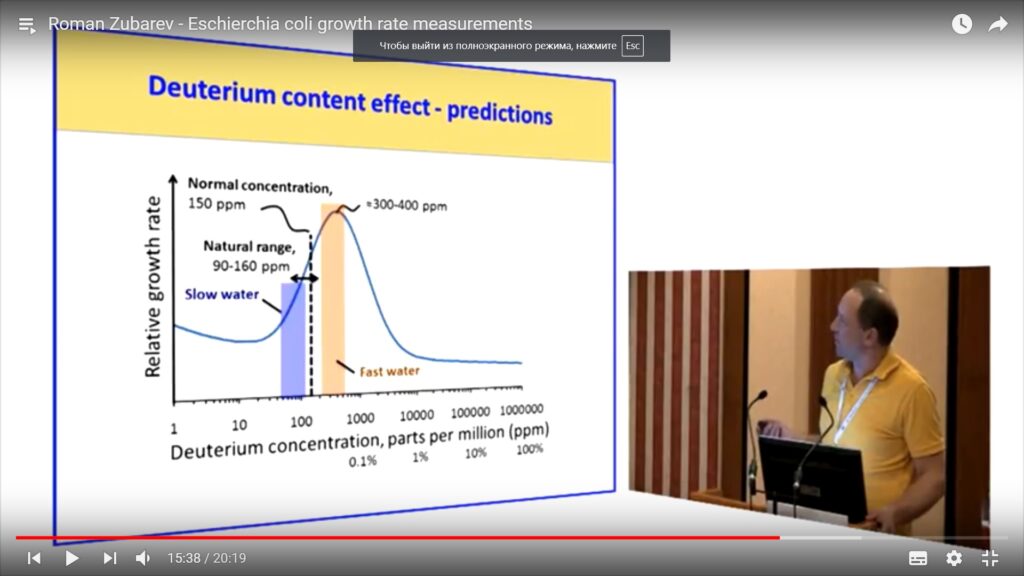
На скриншоте наш экс-соотечественник Роман Зубарев на примере кишечной палочки демонстрирует как дейтерий влияет на скорость роста организма.
Концентрация дейтерия в клеточной воде примерно 155 частиц на миллион (ppm) [частиц водорода].
Из его выступления можем сделать вывод, что у живой клетки есть некое оптимальное окно концентрации дейтерия. И при повышении концентрации дейтерия происходит скачек роста. Применительно к нам это означает более быструю смерть (хотя бы только за счет того, что теломеры могут делиться лишь конечное число раз, то есть наша ДНК не может реплицироваться вечно) и метаболические проблемы (вплоть до рака).
Основа всей выработки энергии: вращение АТФ-синтазы за счет H+ градиента. Более тяжелый D+ будет замедлять вращение АТФ-синтазы, соответственно снижая выработку АТФ. Снижение дыхательной функции митохондрий (то есть снижение выработки АТФ в процессе окислительного фосфорилирования) приводит нас прямиком к теме рака как метаболической болезни.
Чтобы не растекаться мыслью по древу:
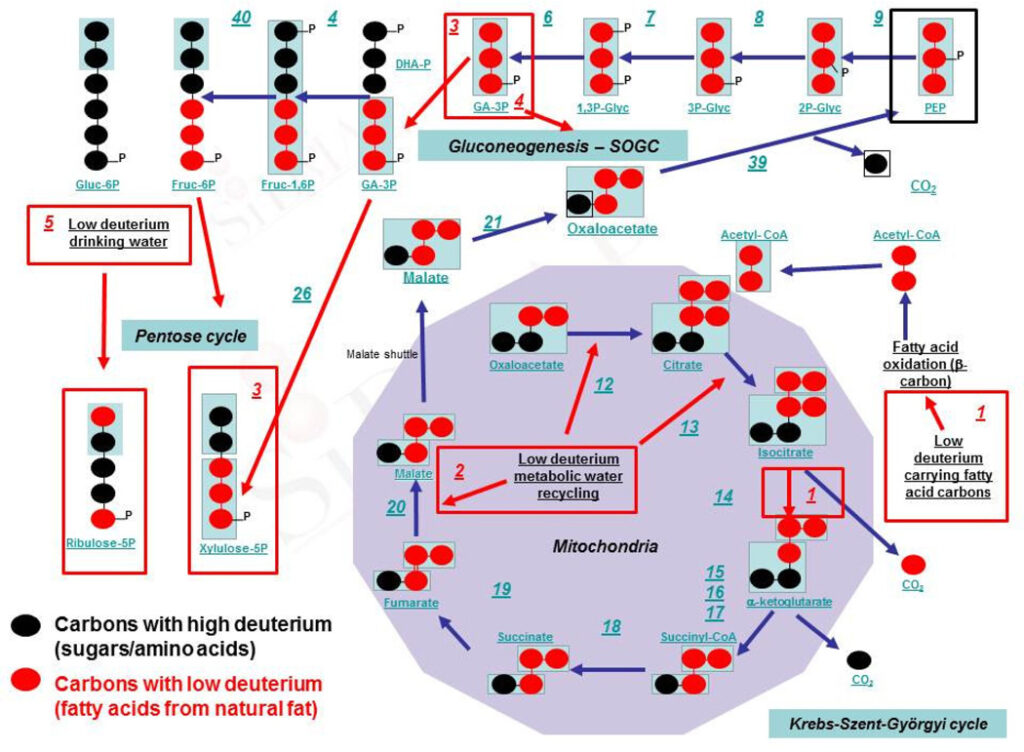
Примечательно, что жировые кислоты содержат меньшее количество дейтерия [8, ссылки 42-44 в 2].
Цифра – цифра на картинке в красном блоке
Дихлорацетат натрия – это экспериментальное лекарство (правда с 40-летней историей применения) от рака. Чей механизм действия находится в фабуле метаболического подхода к заболеванию, о котором я говорил в прошлой заметке.
Напомню, что при всей адаптивности и гетерогенности раковых клеток, они обладают общими чертами. Нарушенная окислительная функция митохондрий. Поэтому митохондрии раковых клеток предпочитают гликолиз (ферментацию глюкозы) вместо окисления этой же глюкозы даже в присутствии кислорода (эффект Варбурга).
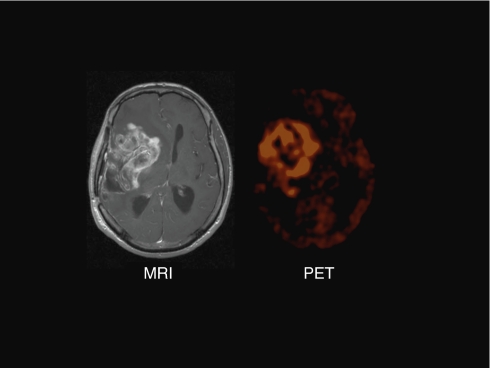
Окисление глюкозы дает 36 АТФ, ферментирование 2 АТФ. Потребность раковых тканей в глюкозе значительно выше, чем у нормальных тканей. Рисунок ниже. Слева МРТ глиобластомы, справа ПЭТ с фтордезоксиглюокзой.
Нюанс в том, что уход в ферментацию сопровождается большим числом адаптаций, способствующих пролиферации раковой клетки.
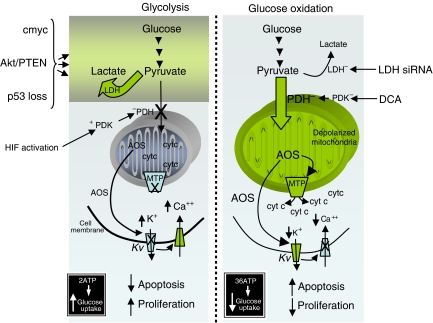
HIF (hypoxia inducible factor) приводит к активации пируват дегидрогеназы киназы (PDK). PDK подавляет пируват дегидрогеназу (PDC). Пируват не превращается в ацетил кофермент А, нет цикла кребса и дыхательного производства АТФ. Пируват дегидрогеназа киназа (PDK) способствует ферментации глюкозы в цитоплазме клетки и метаболизм пирувата до лактата.
Подытожим. Во время рака пируват перерабатывается в лактат, а не в ацетил кофермент А. К слову хочу заметить, что образование ацетил кофермента А из жира проходит не через синтез пирувата.
Образование лактата (НЕ молочной кислоты) снижает pH среды и является токсичным для соседних тканей, помогая опухоли распространяться.
HIF-1α также влияет на дыхательную цепь переноса электронов. В итоге клетка становится менее чувствительной к высвобождению цитохрома с (один из способов апоптоза, клеточного самоуничтожение) и, соответственно, к апоптозу.
Снижение генерации супероксида О2—приводит к гиперполяризации мембраны митохондрий, что закрывает митохондриальную транспортную пору. Цитохром С не может из митохондрии попасть в цитозоль и запустить апоптоз, а Apoptosis inducing factor (AIF) попадать в матрикс митохондрий.
HIF-1α и дерегуляция антиопухолевого белка p53 приводят к активации гексокиназы 2В, которая подавляет апоптоз и способствует пролиферации раковой клетки.
Дисфункция дыхания митохондрий приводит к дерегуляции ионного обмена. В частности закрываются вольт-чувствительные К+ каналы, которые важны для нормальной функции каспазов (альтернативный цитохрому с способ апоптоза).
И так далее. Ферментация существует значительно дальше окислительного производства энергии. Не стоит удивляться, что «враг хитер и коварен». Схематично некоторые моменты обозначены на рисунке ниже.
Дихлорацетат (DCA) – структурный аналог пирувата. С очень низким размером (150 дальтон), что позволяет молекулы проникать в большую часть тканей организма.
Дихлорацетат активирует пируват дегидрогеназу, что дает рост попадания пирувата в митохондрии, что способствует окислению глюкозы, созданию реактивных видов кислорода, деполяризации клетки и другим процессам, обратным тем, чтобы описаны в прошлом разделе.
Дихлорацетат стимулирует потребление кислорода клетками и сдвигает метаболизм с ферментации к дыханию.
DCA подавляет PDK фермент в 3-6 раз, на 60% уменьшая количество лактата.
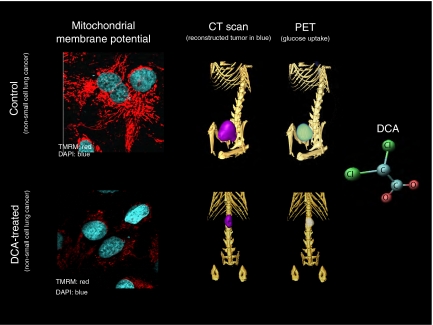
Рисунок выше. Действие DCA на пересаженную опухоль. Чем больше слева красного, тем выше потенциал мембраны митохондрий. Справа видим как опухоль уменьшилась.
Основная проблема – это 4 изоформы пируват дегидрогеназы киназы. DCA лучше всего действует против первой. Хотя есть способы сымитировать эффект DCA по крайней мере на PDK2.
Из нежелательных явлений можно отметить нейропатию у пациентов с митохондриальной миопатией, энцефалопатией, лактоацидозом, инсульто-подобными случаями (MELAS).
Дихлорацетат демонстрирует синергию с метформином [4]. В целом есть тенденция использовать различные метаболические средства, воздействующие на опухоли одновременно [5]. Вопрос в их синергии и соотношения пользы/рисков для пациента.
Рак – это в основном метаболическая болезнь, включающая в себя дисбаланс производства энергии с помощью дыхания и ферментации. Есть 2 подхода к онкологии: как к генетическому заболеванию и как к метаболическому заболеванию. Первый вариант из-за огромного количества переменных очень сложен, второй дает ясную картинку происходящего во всех раковых клетках вне зависимости от их вида.
Томас Сейфрид с коллегами умело замечает, что «невозможность ясно определить происхождение рака во многом предопределяет невозможность значительно уменьшить количество смертей от болезни» [1, 2]. Данные ВОЗ и американской CDC подтверждают этот тренд цифр: распространенность заболевания в целом растёт, смертность незначительно падает [8, 9].
При «генетической» трактовке рак получается генетической соматической болезнью, где повреждение клеточной ДНК предшествует трансформации нормальной клетки в потенциально смертельную раковую. Абнормально выраженные онко-гены, подавленные гены, связанные с подавлением опухолей, – драйверы последних десятилетий исследований заболевания. Миллионы генов, связанных заболеванием, привели ученых к выводу, что это не одно заболевание, а группа различных болезней. В подобной парадигме будущее лечение – индивидуальные терапии, «сшитие» с учетом генетических особенностей и конкретного вида опухоли пациента.
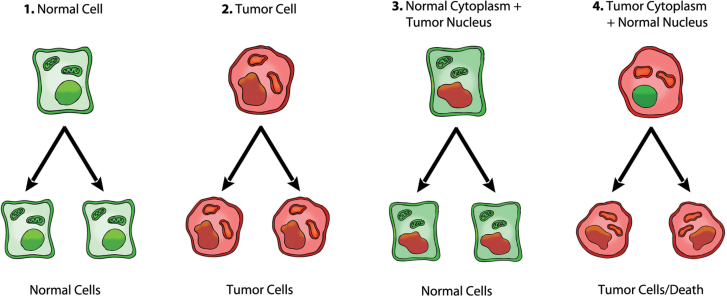
Генетический подход справедливо критикуют (рис 1). Роль ядра и митохондрий в образовании опухолей. Рисунок выше суммирует экспериментальные доказательства, говорящие о лидирующей роли митохондрий в онкогенезе. 1) Нормальные клетки порождают нормальные клетки. 2) Раковые клетки порождают раковые 3) Нормальные клетки, куда поместили ядро из раковых клеток, продолжают порождать нормальные клетки, не смотря на наличие онкогенных генетический аномалий. 4) Раковые клетки, куда помещают нормально ядро, продолжают порождать раковые клетки.
Это говорит о том, что рак связан с дефектами цитоплазы, а не только с генетикой.
Отто Варбург – лауреат нобелевской премии 1931 года, 47-ми кратный номинант этой премии, один из самых видных цитологов 20-го века. Варбург первым предположил, что рак начинается с дисфункционального клеточного дыхания.
Суммируя идеи Варбурга:
Ферментирование глюкозы в присутствии кислорода с производством избытка лактата – «эффект Варбурга», общепринятые индикаторы раковых клеток.
Напомню, после заметной анаэробной нагрузки, при восстановлении уровня кислорода в мышце, уровень лактата значительно снижается. Что в контексте моей заметки говорит о том, что лактат – признак энергетического кризиса в клетке и питает ее, пока полноценное окислительное фосфорилирование (OxPhos далее) не доступно.
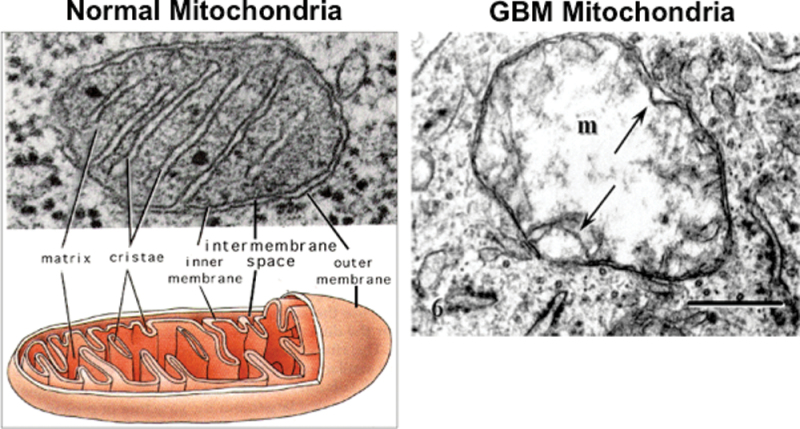
Структура митохондрий тесно связана с их функцией. У раковых клеток проблемы как с количеством, так и со структурой митохондрий.
Слева на рисунке выше вы видите нормальную митохондрию. Вы отчетливо видите кристы, на которых находятся белковые комплексы дыхательной цепи, ответственные за создание АТФ. Справа митохондрия глиобластомы. Отсутствие крист говорит о том, что OxPhos раковой клетки подавлено. Митохондрия справа увеличена в размерах (swelling), что является признаком патологии органеллы.
Окислительное фосфорилирование [дыхательная функция] подавлена в раковых клетках с малочисленными и дефектными митохондриями. Гликолиз и ферментация лактата значительно активируются в раковых клетках, чтобы компенсировать отсутствие OxPhos.
Следующий вклад в доказательство того, что у онкоголических клеток дефектные митохондрии внес Питер Педерсен.
Суммируя выводы профильных экспериментов Педерсена:
Структура, функция и дыхание митохондрий дефектные в том или ином виде во всех раковых клетках. Почти у всех раковых клеток наблюдаются дефекты дыхательной цепи переноса электронов.
Сейфрид с коллегами уделяют почти страницу текста критике на критику своих взглядов. В частности, на выращивание in vitro онкоклеток со «здоровыми» митохондриями. Проблема в том, что без более или менее функционирующих митохондрий «в пробирке» клетку рака не вырастить.
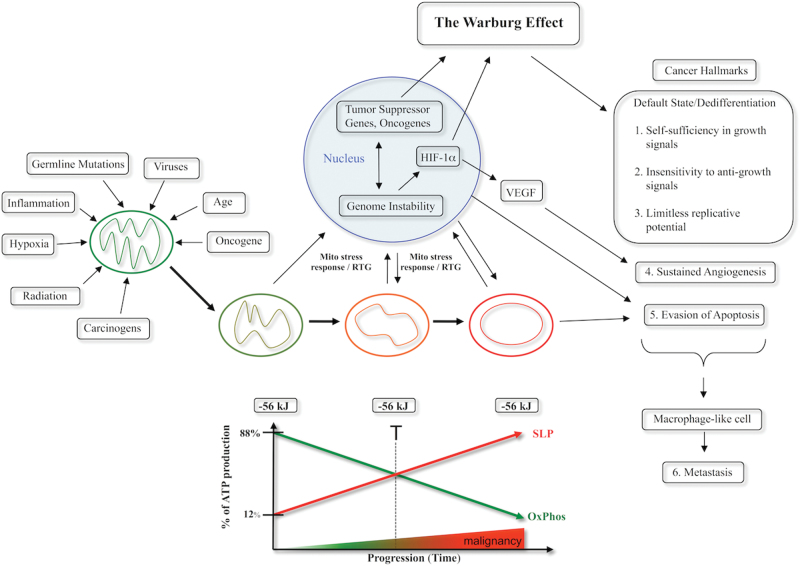
Рисунок 3. Недостаток митохондриальной функции как источник рака. Рак может начаться из-за любых неспецифичных событий, которые со временем повреждают дыхательную функцию клеток. Канцерогенез произойдет только в клетках способных нарастить производство энергии при помощи ферментации (substrate level phosphorylation, SLP). Не смотря на сдвиг от дыхания к ферментации, гидролиз АТФ остается прежним (-56 кДж), так как ферментация компенсируют дефекты дыхания. Митохондриальный стресс активирует онкогены и подавит противораковые гены – это необходимо для поддержания жизни зарождающихся раковых клеток, когда дыхания уже недостаточно для поддержания гомеостаза. Нестабильность генома будет последствием затянувшегося стресса митохондрий, вызванного нарушениями внутреннего и внешнего микроокружения. Метастазы начинаются из-за «дыхательного» урона миелоидным клеткам и макрофагам. Степень злокачественности напрямую связана с переходом от OxPhos к ферментации. Этот сценарий связывает все основные признаки рака с внехромосомными нарушениями дыхательной функции митохондрий. «Т» на графике – произвольная точка невозврата, когда переход к ферментации становится необратимым.
Любое неспецифичный процесс, который повреждает дыхательную способность клетки, может (may or may not) инициировать путь к злокачественной опухоли. Снижение дыхательной функции может быть обусловлено уроном митохондриальным белкам, жирам, мтДНК. Например, воспаление, канцерогены, радиация (ионизирующее или ультрафиолетовое), гипоксия, редкие мутации, вирусные инфекции, возраст.
При сильном уроне – клетка умрёт. При слабом клетка может активировать ферментацию, чтобы компенсировать недостаточную дыхательную функцию.
Необузданная пролиферация связана с ферментацией, которая была доминирующей формой энергетического метаболизма во временя дефицита кислорода ранней истории Земли. Недостаточность OxPhos в гибридах (fusion) иммунных клеток и стволовых раковых клеток может предшествовать способности раковых клеток попадать с кровоснабжением в другие части организма и распространяться локально. Последнее по мнению Сефрида и коллег объясняет метастазы.
Ras – онкоген, p53 – противоопухолевый ген. Сефрид с коллегами умело аргументирует, что дефекты p53 гена связаны с дефектами дыхательной функции митохондрий. Дефекты этого гена можно рассматривать как вторичные по отношению к дыхательной функции. Тоже самое можно сказать и про Ras-гены
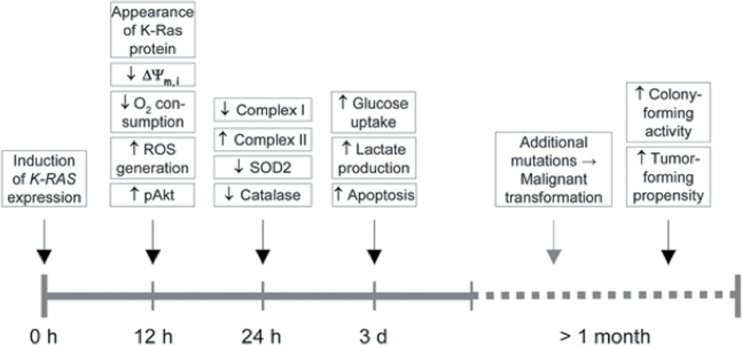
Рисунок 4. Временная шкала процессов после экспрессии Ras-онкогена. По тайм-лайну видно, что ферментация и онкогенез начинают с того, что Ras нарушает нормальную дыхательную функцию. Это на данных in vitro, in vivo таймлайн будет значительно более растянутым.
И деактивация p53 и активация Ras имеют негативный эффект с точки зрения развития онкологической патологии именно за счет подавления дыхательной функции митохондрий. На рисунке ниже из исследования [4] это наглядно видно.
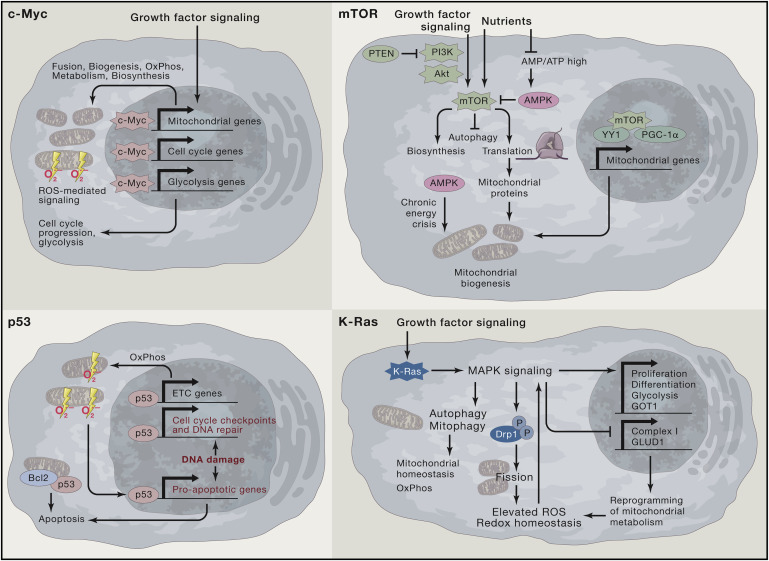
Постоянный ретроградный стрессовый сигнал от митохондрий приводит к аномалиям механизма починки ДНК. Для кальциевого и анионного гомеостаза также нужна полноценная дыхательная функция.
В эволюционном контексте метаболический взгляд на рак больше соответствует эволюции по Ламарку, чем по Дарвину. У Дарвина соматические мутации являются драйверами болезней. А в эволюционной теории Ламарка окружающая среда приводит к изменению в биологических структурах. Посредством адаптации и дифференциальному использованию [своих функций] организмы могут модифицировать свои структуры. Современными словами эволюция Дарвина больше о «генетике» (в кавычках, так как Мендель был уже после Дарвина), а Ламарк об эпигенетике. Дисфункция [митохондрий] в таком случае может быть распространена соматически (по организму) через клеточное наследование или передаться детям.
Кетогенная диета – это высоко жировая и низко-углеводная диета, во время которой уровень глюкозы снижается, а уровень кетонов в крови расти. Выработка АТФ происходит за счет бета-оксидации жиров и кетоновых тел в первую очередь бета-гидроксибутирата (BOHB). С функциональной точки зрения кето-диета – это частичная имитация эффектов голодания без ограничения в еде и значимой катаболической части процессов голодания.
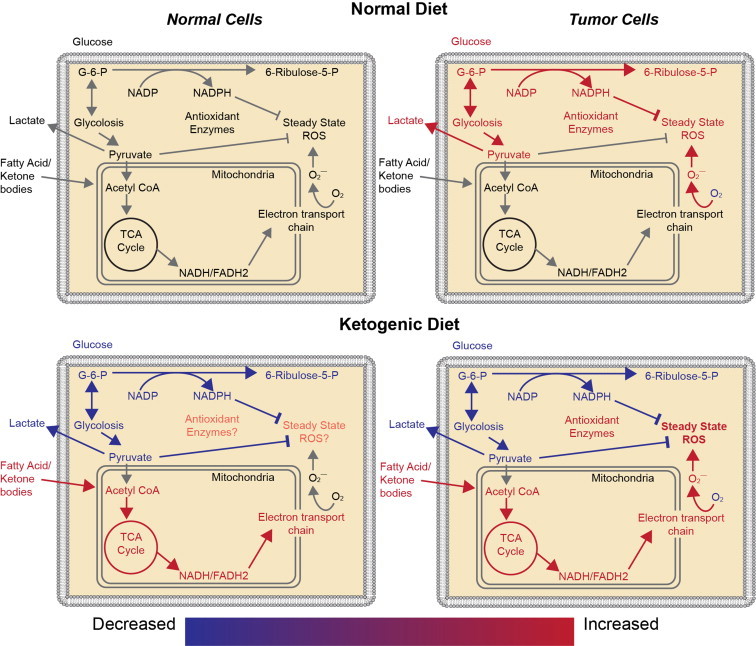
Как видите, кето в значительной мере «качает» чашу метаболизма в сторону окисления жиров и подавления гликолиза, что действует на рак как метаболический стресс. В целом оппуртунистические клетки рака выживают, когда субстрат для ферментации в изобилии.
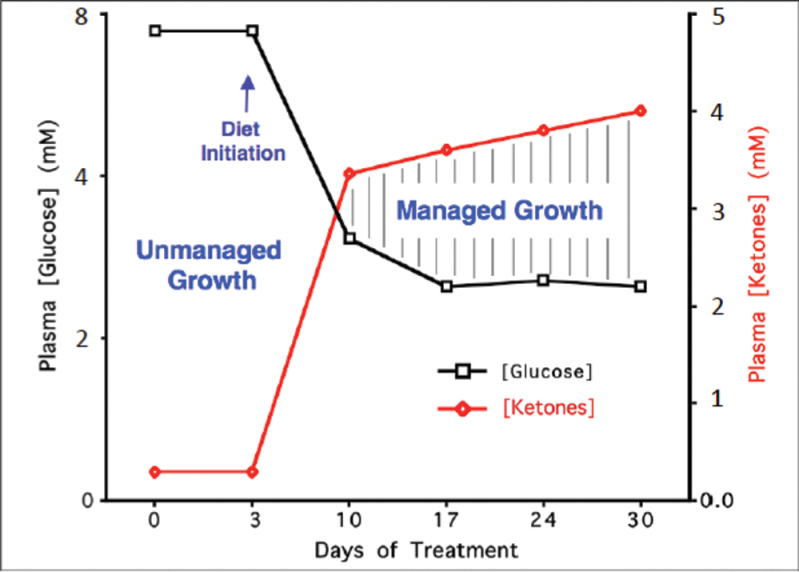
Взаимоотношения концентрации глюкозы и кетонов (бета-гидроксибутирата) от отношению к росту опухоли. Значения глюкозы и кетонов находятся в физиологических значениях и способствуют антиангиогенному, противовоспалительному и про-апоптотическому (смертельному) эффекту в рамках опухоли. Это состояние на рисунке отмечено как «managed growth». Уровень глюкозы в крови – один из факторов прогноза развития опухоли. Указанный уровень кетонов значительно ниже уровня, который бывает при кетоацидозе (15+ ммоль). Повышенный уровень кетонов защищает мозг от гипогликемии.
Некоторые препараты химиотерапии (например, иматиниб, трастузумаб) воздействуют на метаболизм глюкозы. По отношению к этим препаратам кето является нетоксичной метаболической терапией.
Сейфрид с коллегами пишет о важности ограничения калорий во время кето-диеты. Бесконтрольное потребление пищи на кето может привести к скачкам инсулина и глюкозы вне зависимости от присутствия углеводов в пище. На кето, как правило, сложно переесть из-за большого процента жира в диете и подавления чувства голода.
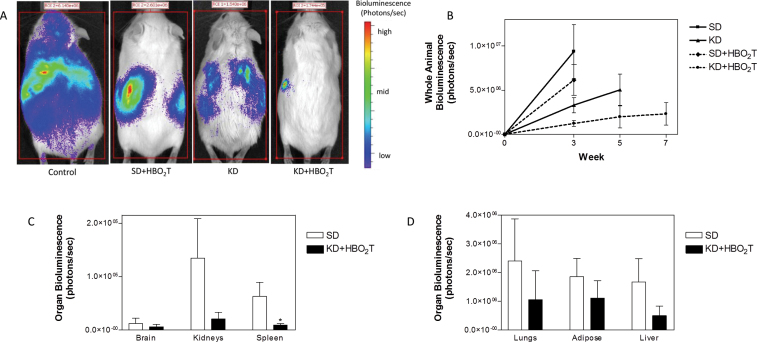
Кето и ГБО синергично подавляют рак в метастатической стадии. Клетки рака (VM-M3/Fluc) вживили мышам подкожно и в системные органы. Метастазы оценивали ex vivo при помощи биолюминисценции. Рост опухоли был ниже в кето-группе, чем в группе с обычной углеводной диетой. A) Животные каждой группы лечения через 21 день после вживления опухоли: синергия гипербарической оксигенации и кето-диеты дала наилучший эффект из представленных. B) Биолюминисценция опухоли измерялась на еженедельной основе. C и D) Биолюминисценция опухоли в отдельных органах. Комбинированная терапия смогла уменьшить вред опухоли внутренним органам.
Подобная комбинированная терапия повышает количество реактивных видов кислорода в раковых клетках (как и кето, как и радиация, как и химеотерапия). Комбо кето + ГБО эффективно на примере выше подавляло рост раковой опухоли и не было токсично для организма.
Исследователи описывают подобную стратегию как Press-Pulse. Кето – это постоянно метаболическое давление на раковые клетки (press), ГБО или лекарства действуют на рак как уничтожающий “pulse”. Лекарства: 2-деоксиглюкоза, 3-бромопируват, дихлороацетат. Подобные терапии могут не только остановить рак, но и улучшить здоровье в целом.
Я намеренно не размывал фокус заметки, центром которой является митохондрия в раковых клетках. Апоптоз – это клеточная смерть, ему посвящена статья Судьба хуже смерти: апоптоз как онкогенный процесс [5], которую я рекомендую (но не для всех).
Клеточная смерть, не смотря на некоторую контринтуитивность этого тезиса, может быть онкогенной. В статье рассматриваются внешние и внутренние сценарии «клеточной смерти». Затем приводятся примеры того как апоптоз стимулирует рак. Питание для соседний клеток, вакантное место для более живучих раковых клеток. Статья интересная, но с большим количеством специфической терминологии, которую я в текущей заметке про рак решил избежать. Ограничусь одним рисунком.
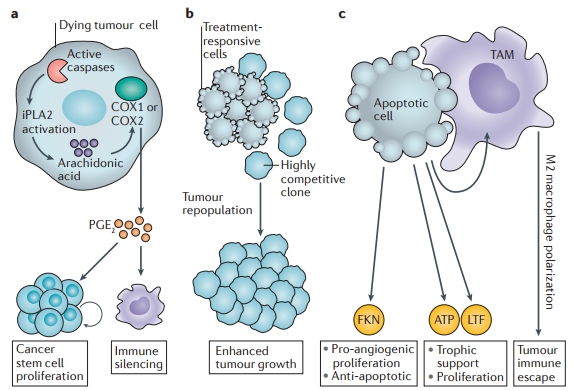
а) Смерть клетки может предоставить полезные для окружающих раковых клеток белковые структуры; b) Апоптоз может освободить вакантную нишу для более жизнеспособных раковых клеток, приводя к росту опухоли и устойчивости терапии; c) Умирающие клетки рака могут высвобождать молекулы, сигнализирующие иммунной системе «найди меня», «съешь меня». Подобные сигналы могут иметь различные эффекты, стимулирующие рост опухоли.
Цитокины модулируют иммунный ответ организма. Грибы обладают рядом полезных медицинских свойств. Меня привлекла статья об иммунномодулирующих свойствах грибов и их применении в онкологии.
| Паттерн | Цитокины | Эффект |
|---|---|---|
| TH1 | IFN-γ, IL-12, TNF-α | Стимулирует иммунный ответ раку |
| TH2 | IL-4, IL-5, IL-13 | Снижают TH1 |
| TH3/Treg | TGF-β | Модулируют TH1 |
| Про-воспалительные | IL-1, IL-6, IL-8, TNF-α | Вызывают воспаление |
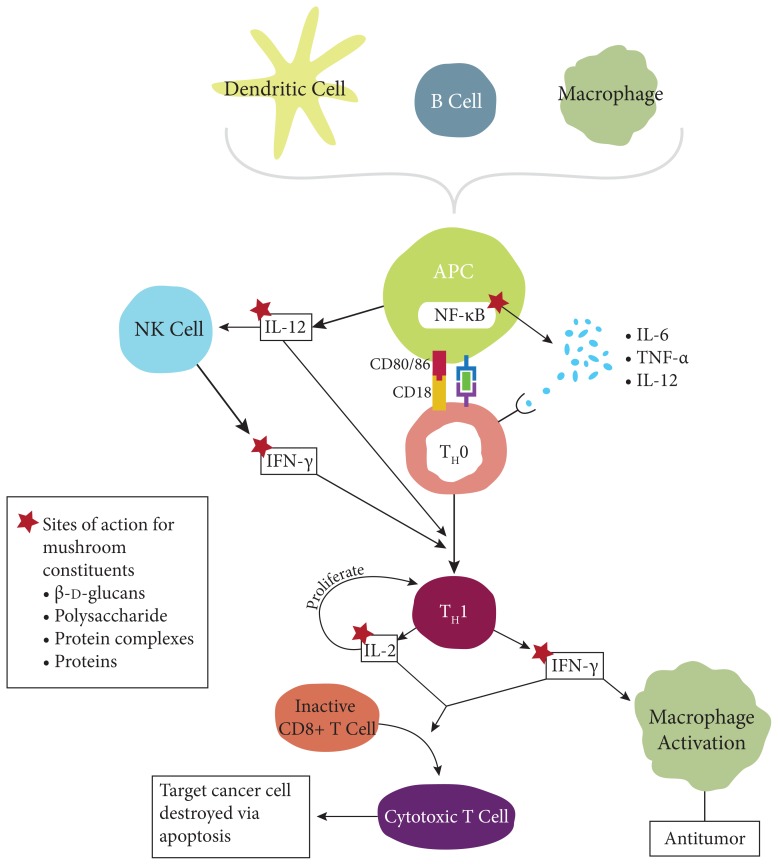
Доминирующим TH1-цитокином является IFN-γ, который отвечает за стимуляцию клеточного иммунного ответа. Клеточный иммунитет имеет важное значение в противоопухолевой реакции, поскольку NK (natural killer) и CD8 + Т-клетки, а также опухолевые макрофаги могут разрушать опухолевые клетки. Кроме того, IFN-γ увеличивает количество клеточных функций, таких как представление опухолеспецифических антигенов и продуцирование опухолевых цитокинов. Использование грибов, которые увеличивают [концентрацию] IFN-γ и стимулируют ответ TH1, полезно для раковых больных.
В отличие от ответа TH1, ответ TH2 обычно не ассоциируется с иммунным ответом на рак. Реакции TH2 связаны с аллергией и астмой и включают цитокины IL-4, IL-5, IL-13, а иногда и IL-10. Самое главное, IL-4 и IFN-γ перекрестно регулируют друг друга. IFN-γ уменьшает продукцию IL-4, а IL-4 снижает продукцию IFN-γ. Таким образом, апрегуляция TH2 может нанести ущерб больным раком, поскольку он уменьшает IFN-γ и снижает клеточный иммунный ответ к раку.
Регулирование ответа Т-клеток осуществляют клетками Treg, также называемыми клетками TH3 или Treg. Хотя существует много категорий клеток Treg, большинство Tregs продуцируют TGF-β (трансформирующий фактор роста бета). Эти цитокины были обнаружены благодаря их способности увеличивать рост опухолевых клеток, на фоне уменьшения ответа TH1. TGF-β также может уменьшать TH2-ответы.
При рассмотрении иммуномодулирующих эффектов грибов нам подходят:
Грибы, которые уменьшают воспаление, могут иметь дополнительное преимущество за счет снятия усталости, тревоги и других симптомов за счет уменьшения воспалительных цитокинов (IL-1, IL-6, TNF-α).
Авторы статьи рассматривают 5 видов грибов:
Меня заинтересовало то, что рейши и кордицепс снижают концентрацию фермента MMP-9. Этот фермент сильнее выражен во время рака и аутоиммунных заболеваний. Также его повышенная активность мешает заживлению эрозии роговицы. Еще не так давно я планировать рассмативал варианты курса доксициклина или иммуннодепрессантов для ускоренного заживления эрозии роговицы как раз затем, чтобы уменьшить концентрацию MMP-9. Оказывается это можно сделать столь значимых интервенций, а всего лишь грибами.
В исследовании (бесплатный полный доступ) подробно рассматриваются исследования каждого из перечисленных грибов и его иммунномодулирующих свойств. Таблицы настолько нагляды и понятны, что не хочу сюда их копировать. Снижение Th2 и Treg, повышение Th1 и другие потенциально полезные для онкологии изменения в иммунной системе.
Грибы и рак
Хочется остановиться на том, что перечисленные выше грибы успешно дополняют терапевтический эффект препаратов химиотерапии и даже радиотерапии. Совместное применение определенных грибов с определенными препаратами при определенных видах рака значительно снижало смертность и прогресс болезни.
Как пример таблица из исследования:
| Chemotherapeutic Agent | Indicated Mushroom | |
|---|---|---|
| Trastudzumab | PSK (turkey tail) | |
| Cyclophosphamide | Reishi | |
| Cisplatin | Maitake, Cordyceps, reishi | |
| Docetaxel | PSK (turkey tail) | |
| Doxorubicin | Agaricus |
Например, “индюшиных хвост” значительно увеличивает цитотоксичность Герцептина (ммн трастузумаб). Или кордицепс может увеличивать цитотоксичность цисплатина.
Бета-глюканы из рейши очень сильно повышали выживаемость мышей после радиционного облучения.
| Type of Cancer | Indicated Mushroom |
|---|---|
| Nonsmall-cell lung cancer | Cordyceps |
| Lung cancer | Reishi |
| Gastric cancer | PSK (turkey tail) |
| Hepatocellular carcinoma | Agaricus, reishi |
| Leukemia | Agaricus, reishi |
| Lymphoma | Cordyceps |
| Breast cancer | Reishi, maitake, turkey tail |
| Colon cancer | Maitake, reishi, turkey tail |
| Prostate cancer | Reishi |
| Sarcoma | Reishi |
Медицинские грибы, модулирующие цитокины, – это относительно новая (не более 5 лет) вспомогательная терапия в лечении различных видов рака. Эффекты этих грибов я склонен экстраполировать с рака на модуляцию работы иммунной системы в целом. Что может быть полезно для аутоиммунных заболеваний.