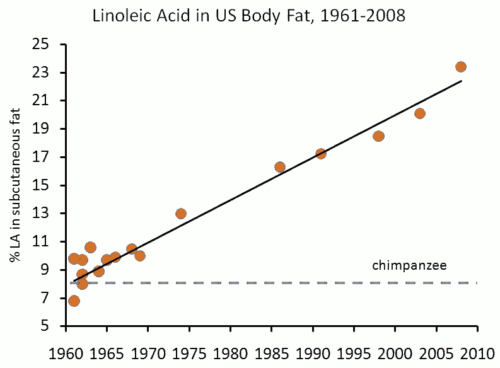
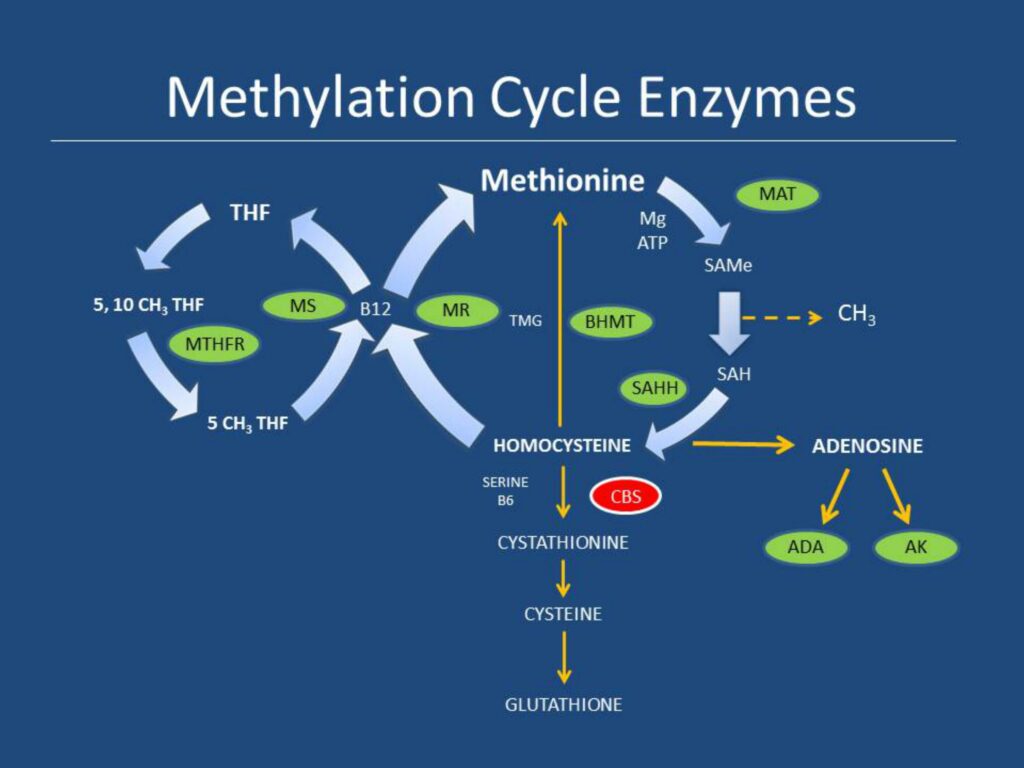
Эпигенетика – злободневная и противоречивая тема современной науки. Противоречивая, потому что нет единого научного консенсуса в том, что входит понятие эпигенетика.
Я буду исходить из того, что эпигенетические изменения – это наследуемые изменения функции или экспрессии генетического аппарата, не связанные с последовательностью нуклеотидов в ДНК.
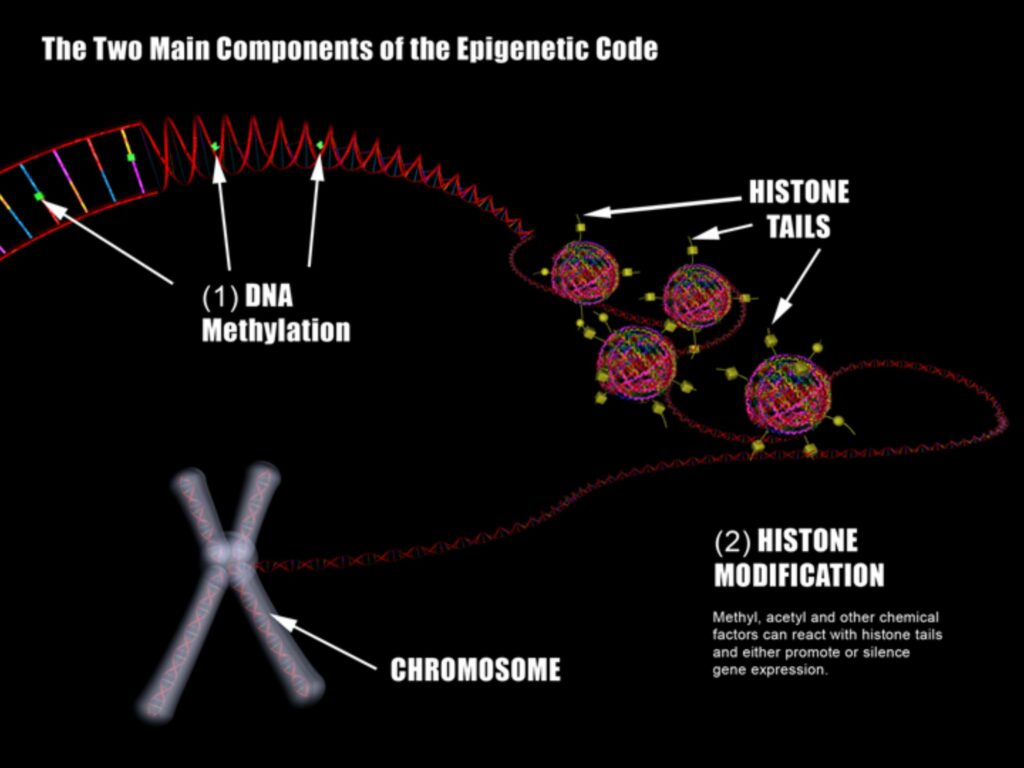
Эпигенетика часто сводится к метилированию ДНК и [пост-трансляционной] модификации «хвостиков» гистонов. Я обнаглею и позволю себе посмотреть на этот вопрос немного шире и более фрагментарно одновременно, чтобы подчеркнуть связь генетического аппарата с внешней средой и образом жизни. Содержание постараюсь сделать доступным и буду приводить примеры с конкретными заболеваниями.
Короткое содержание заметки:
- мтДНК, митохондриальные болезни, заместительная митохондриальная терапия;
- Unstable repeats;
- Модификация гистонов;
- Генетический импринтинг;
- Х-инактивация у женщин;
Эпигенетика, митохондрии и мтДНК
Пожалуй, самый спорный раздел из вышеуказанных, но без митохондрий никуда.
Митохондрия – это энергостанции наших клеток, база всей многоклеточной жизни на планете. Про мтДНК и эволюцию я писал ранее на основе работ Doug Wallace. Также рекомендую книги Ника Лэйна для ознакомления с историей симбиоза наших предков с митохондриями.
Коротко, митохондрии:
- Свой набор ДНК, митохондриальные ДНК, мтДНК;
- В митохондрии примерно 5 копий мтДНК;
- Размер мтДНК 16,5 килобаз, против 3 гигабаз ядерной ДНК;
- мтДНК содержит 14 protein coding regions, ядерная ДНК содержит примерно 20 000 protein coding regions;
- мтДНК мутирует в 20 быстрее ДНК;
- мтДНК передается (за редчайшим исключением) только от матери
Гены митоходрий кодируют только белки дыхательной цепи переноса электронов, места синтеза АТФ. Большинство необходимых белков митохондрии импортируют из цитозоли. Современный консенсус состоит в том, что было сильное эволюционное давление на то, чтобы определенные белки дыхательной цепи кодировали сами митохондрии.
мтДНК меньше защищена от внешнего воздействия, чем ядерная ДНК, поэтому митоходрия является сенсором изменений окружающего мира. Я ранее приводил в пример климат и расстояние между цитохромами дыхательной цепи. В теплом климате цитохромы ближе к друг другу, что уменьшает энергопотери в процессе переноса электронов и улучшает эффективность синтеза АТФ. Что, допустим, положительно влияет на подвижность спермы, которая обеспечивается как раз АТФ. На холоде же дыхательные комплексы дальше друг от друга. При удалении комплексов друг от друга передача электронов будет сопровождаться большими теплопотерями (даже не говоря о термогенине и разобщении H+ градиента), что является полезным для проживания на этом самом холоде.
Или более простой пример. Голод или сытость определяются наличием отсутствием реактивных видов кислорода, затем через UCP2 (разобращающий белок 2) влияет на POMC нейроны гипоталамуса и затем на чувство сытости. А наличие/отсутствие реактивных видов кислородов в митоходриях – это наличие/отсутствие носителей электронов NADH/FADH2 (итога метаболизма еды) в дыхательной цепи.
Я надеюсь, что вкратце сумел аргументировать, почему эпигенетика как тема не может идти отдельно от разговора от митохондриях. Один из важнейших наших детекторов внешней среды, который запускает многие адаптивные процессы. Как элементарный пример.
Митохондриальные болезни, синдром Ли и пересадка здоровых митохондрий
Митохондриальные болезни могут быть связаны не только с мтДНК, но и с 100+ генов ДНК, что задачу только усложняет [1]. В целом болезни, связанные с мутациями именно мтДНК имеют частоту распространения 1:5000.
Как пример серьезного недуга именно митохондриальной природы – синдром Ли (иногда пишут Лея) [2], он же подострая некротизирующая энцефаломиопатия. Примерно ¾ случаев обусловлены мутациями ДНК, ¼ – мтДНК. Итог схожий – недостаток окислительного фосфорилирования (в частности работы цитохрома С) приводит к недостатку энергоснабжения клеток и последующей ранней смерти.
Mitochondrial replacement therapy – это одно из последних серьезных новаторств ЭКО. Берется ДНК из ооцита пациентки c патологией мтДНК и пересаживается в цитозоль ооцита женщины-донора со здоровыми митохондриями, откуда вынули ДНК донора [3, 4]. В новостях это называли «ребенок трёх родителей» [4].
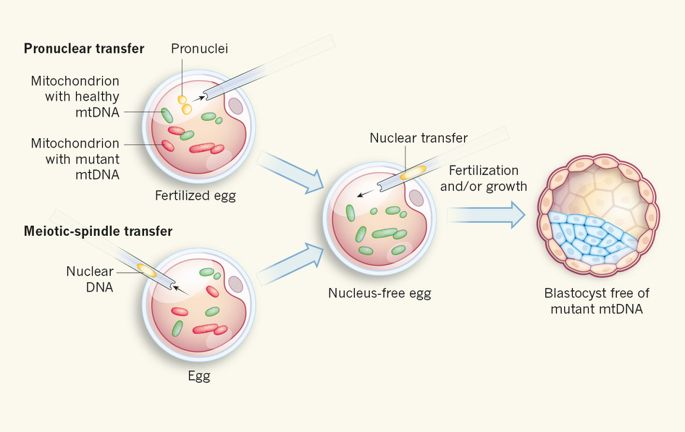
Я не зря выбрал синдром Ли. Первой пациентой, ооцитам которой успешно пересадили здоровые митохондрии, была женщина с синдромом Ли [4]. Этические споры до сих пор не утихают, что никак не мешает совсем молодому человеку жить по крайней мере без синдрома Ли и недостатка в АТФ.
Эпигенетика и unstable repeats
В некоторых частях ДНК есть так называемые нестабильные повторения, когда небольшая последовательность нуклеодитов многократно повторяется [5, 6, 7]. Считается, что в некоторых частях ДНК механизмы починки и репликации «соскальзывают», давая подобные повторения [5, 6, 7].
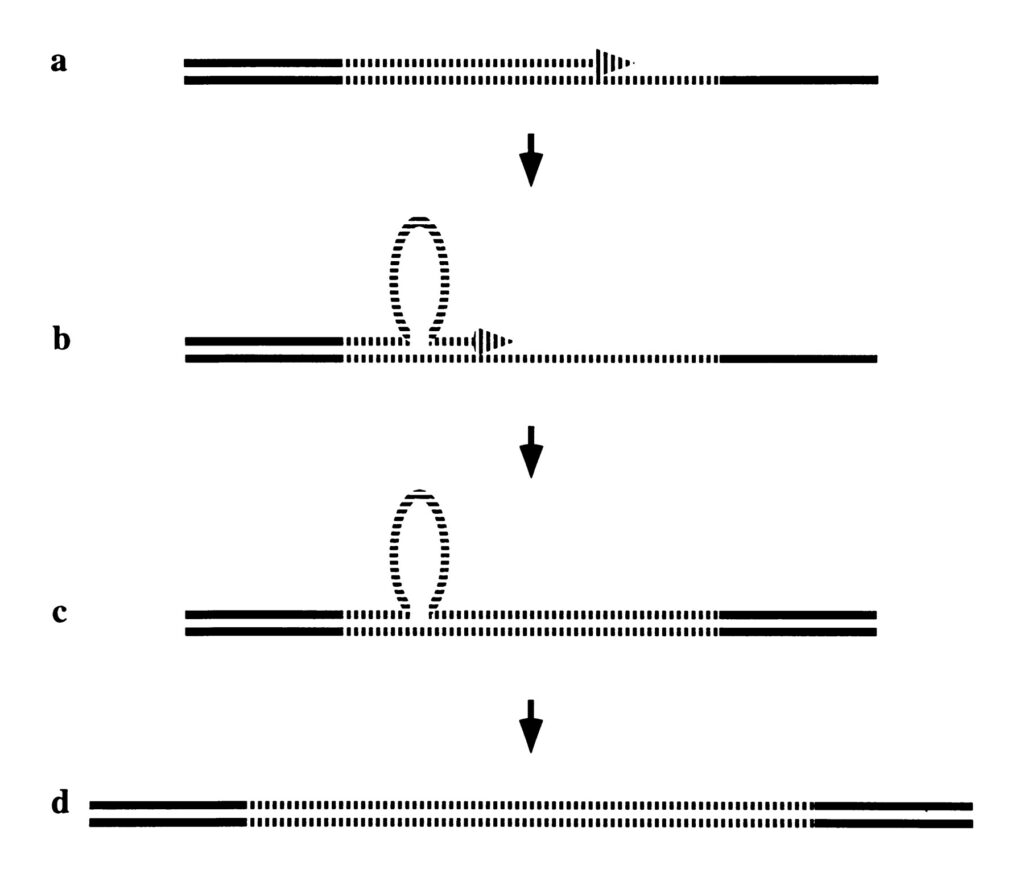
Проблема нестабильных повторений в том, что они с поколениями могут увеличиваться [5-6]. Увеличение unstable repeats с поколениями называется anticipation.
Unstable repeats, HTT ген и хорея Гентингтона
Хорея Гентинтона – в основном генетическая болезнь. Белок huntingtin, роль которого в развитии профильного заболевания толком не ясна, кодирует ген HTT, находящийcя в позиции 4p16.3 (короткая «ручка» 4-й хромосомы). Когда число повторений становится слишком большим – белок теряет свою функцию, и последующие поколения постепенно приходят к болезни Гентингтона.
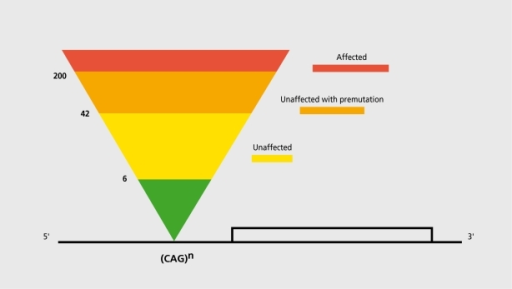
Обычно есть такая пирамида, в случае хореи Гентингтона это:
- Доброкачественная (benign) вариация – Меньше 26 повторений CAG;
- Промежуточная (intermediate) вариация – 27 – 35 повторений CAG;
- Пре-мутация – 36-40 повторений CAG;
- Патологическая мутация – больше 40 повторений CAG
Может ли эпигенетика включать наследуемую патологию роста количества нестабильных повторений в HТТ гене? Будем считать, что я много могу себе позволить в собственной же заметке.
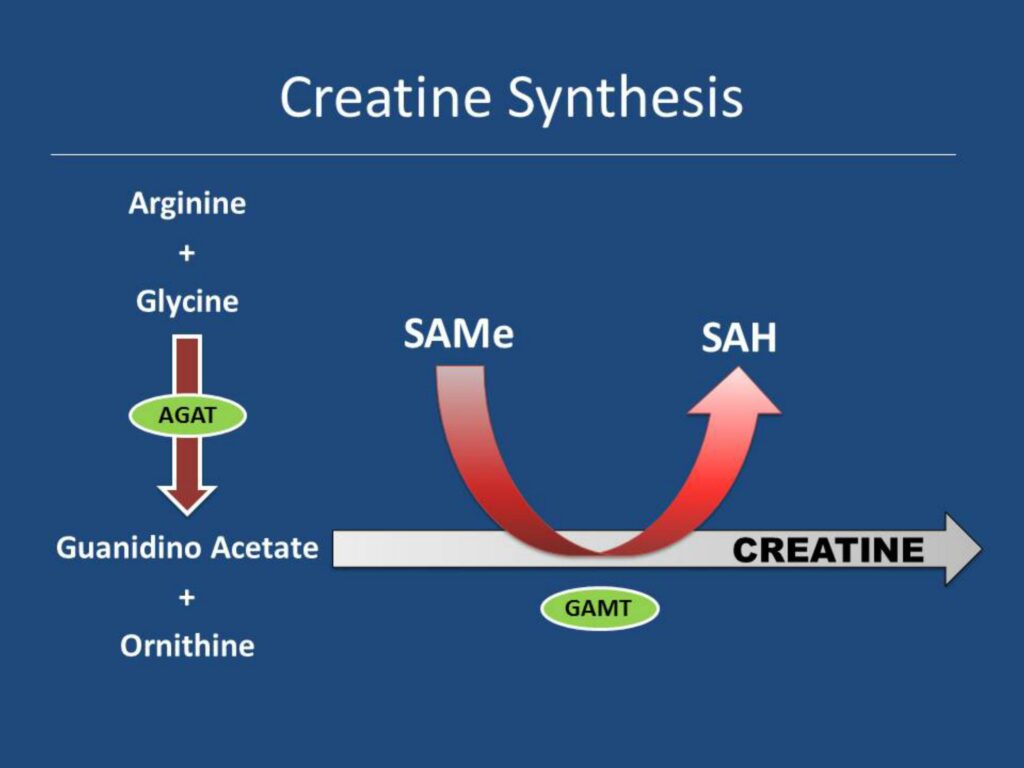
Эпигенетика и пост-трансляционная модификация гистонов
3 гигабазы ДНК занимают примерно 2 метра, будучи (в воображении) вытянутыми в длину. Эти 2 метра кода упакованы по хромосомам.
Хроматин – вещество хромосом, которое кроме ДНК включает в себя РНК и белки.
Нуклеосомы – это часть ДНК, обвитая вокруг октамерных белков гистонов (обычно два раза).
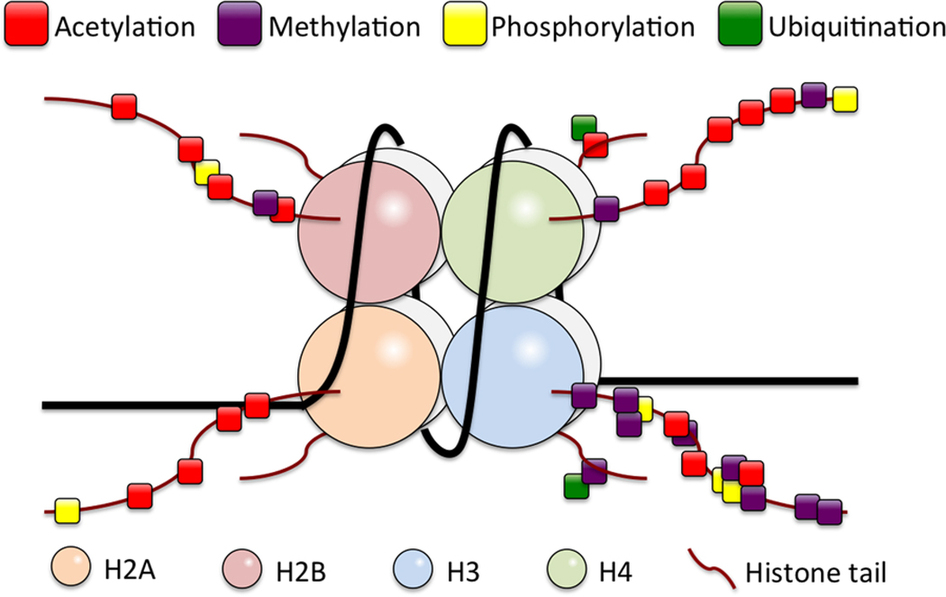
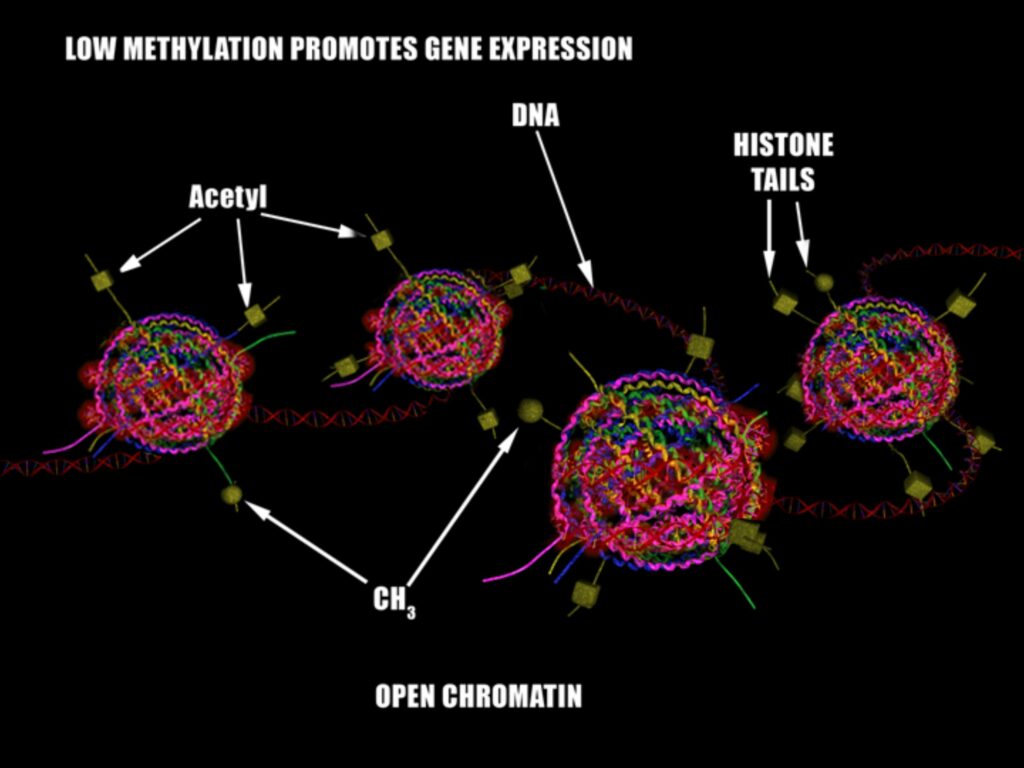
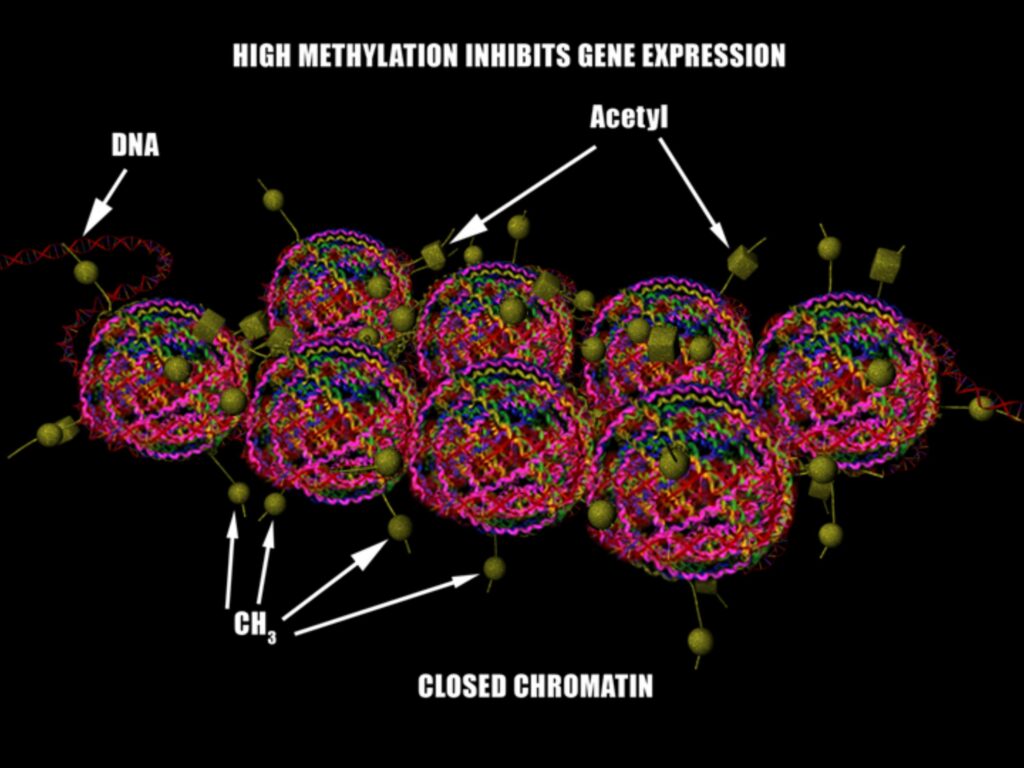
Гистоновый октамер состоит из 2 копий гистонов H2A, H2B, H3 и H4, как это видно на рисунке выше. N (и реже С) терминалы гистонов проходят пост-трансляционную модификацию. К ним ковалентно могут присоединяться различные молекулы. Например, метиловая группа (CH3) или ацетиловая группа (C2H3O).
Проблема модификации гистонов к комплексности и объемности происходящего. Допустим, H3K4 – самая изученная часть гистонов, ее метилирование и ацетилирование усиливают транскрипцию гена, а метилирование H3K9 на том же H3 гистоне подавляет транскрипцию гена. Разные виды пострансляционных модификаций разных частей гистонов делает картину эпигеном/геном куда более сложной, чем сам геном.
Очевидный пример – возрастные изменения [9]. Какие-то модификации гистонов и хроматина аккумулируются, какие-то теряются.
Эпигенетика и генетический импринтинг
Метилированию может подвергнуться и сама ДНК. В зависимости от места метилирования по отношению к гену эта модификация может как усилить экспрессию гена, так и прекратить его выраженность вовсе.
«Рычажки» метилирования ДНК сбрасываются примерно на 5-й день существования зиготы. Но иногда эпигенетика преподносит нам сюрприз – метилирование участков ДНК частично сохраняется. Это и есть генетический импринтинг.
Классический пример генетического импринтинга – синдромы Ангельмана и Прадера-Вилли.
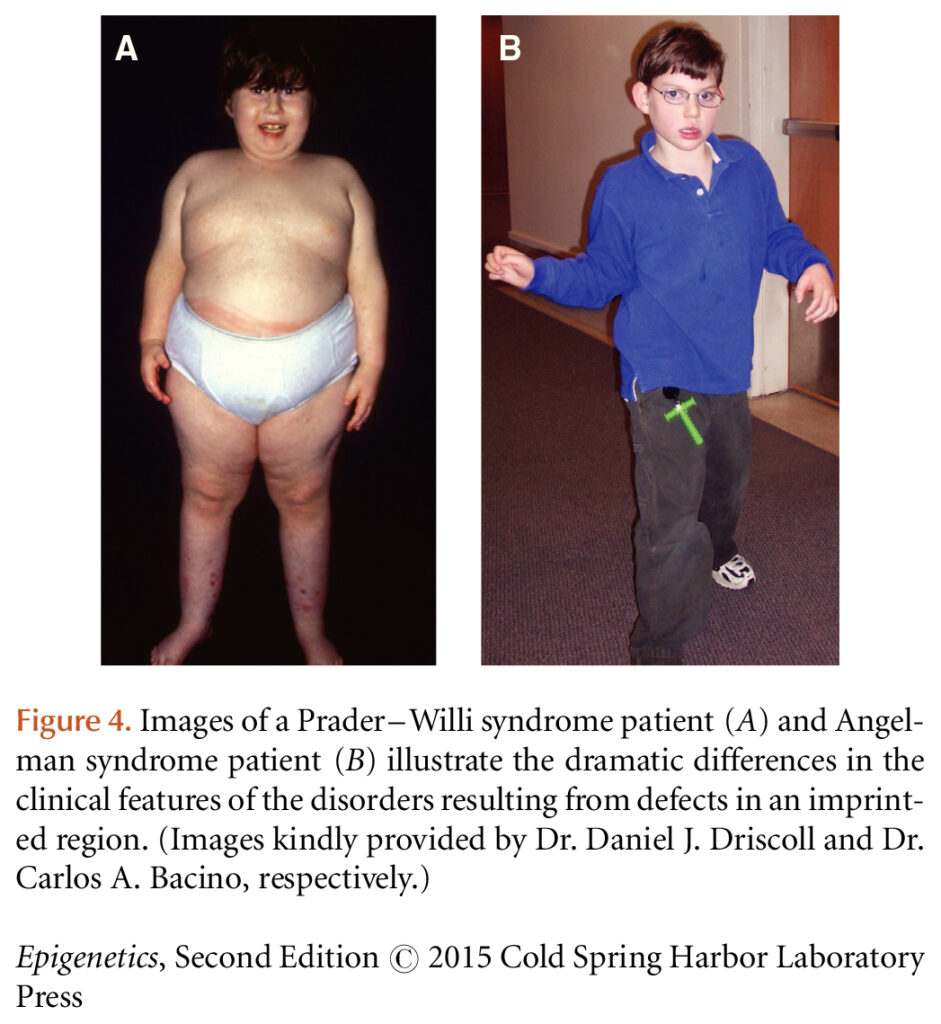
Эпигенетика преподнесла сюрпризы, потому что со временем оказалось, что у двух редких и различных заболеваний схожая природа – удаление в 15q11 части хромосомы в виду импринтинга (конкретный механизм пропущу, потому что начинаю скучать во время написания).
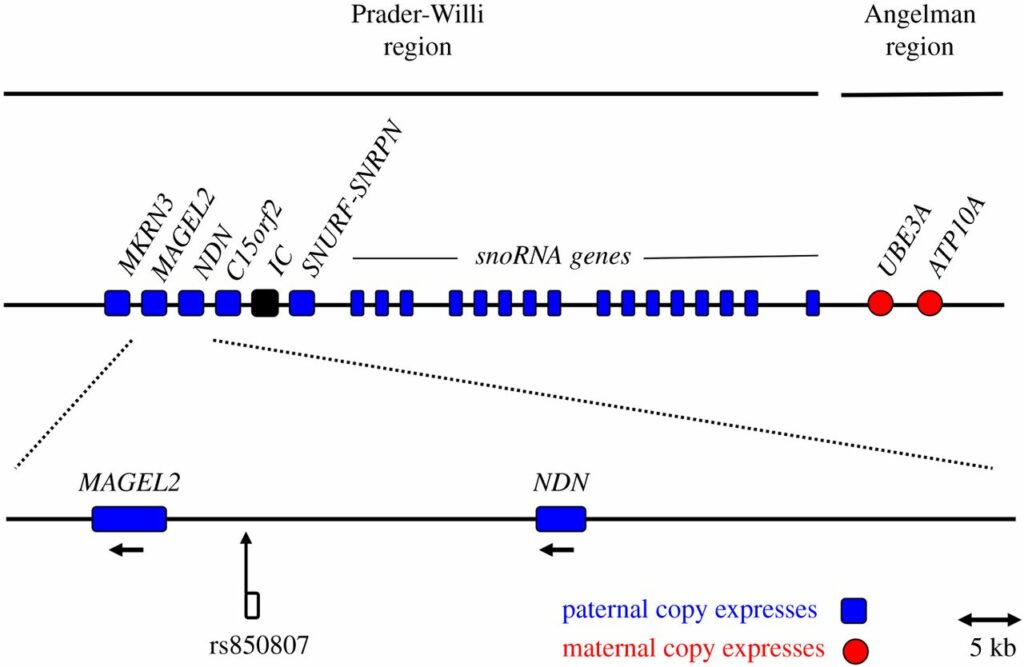
Синдром Ангельмана – удаление отцовской части 15q11 и выраженность материнской. Синдром Прадера-Вилли – наоборот.
Материнская и отцовская части транскриптируются на встречу друг другу. ДНК у нас двойная спиральная, поэтому может транскриптироваться в обе стороны.
Либо продолжительная и некодирующая белок РНК помешает выраженности UBE3A гена, и мы столкнемся с синдром Прадера-Вилли. Или, как в случае с выраженностью материнской копии, у нас не будет трансприптирован ряд генов (синих на рисунке выше), важных для развития в том числе нервной системы.
Эпигенетика и деактивация Х-хромосомы у женщин
Женщины – генетическая мозаика. Ряд несознательных граждан склонных это интерпретировать как телегонию. То, что контакты женщин с мужчинами (особенно половые), оставляют в женщинах свой генетический след. Я бы не писал про эту глупость, если бы так часть ее не видел. Но учитывая то, что в каждом из нас есть части хромосом двух бабушек и двух дедушек, то найти различные части ДНК у женщин не так сложно, учитывая следующий феномен.
Мужчины, как вы помните, ХУ, а женщины ХХ. Пол определяет наличие/отсутствие У хромосомы. Но у женщин активна только одна Х хромосома. В каждой клетке какая именно Х хромосома будет активна выбирается более или менее случайно.
XIST ген кодирует большую РНК (которая не транслируется в белок). Эта РНК деактивирует одну из Х хромосом.
С этим феноменом связан эффект manifesting carriers, когда женщины частично экспрессируют патогенный фенотип, связанный с рецессивным Х-аллелем (нужна хотя бы одна рабочая копия, чтобы не было болезни): и в каких-то клетках у нас «здоровая» вариация, в каких-то патогенная.
P.S. Выводов не будет. Для себя я понял, что писать общеобразовательные вещи в формате заметок мне скучно: нет моей мысли, нет моей аналитики, не надо создавать структуру для общего понимания итд.
Источники:
- Mitochondrial Disorders Overview;
- Leigh syndrome;
- Biomedicine: Replacing the cell’s power plants (Nature, 2016);
- First ‘three person baby’ born using new method;
- Unstable Triplet Repeat Diseases;
- R loops stimulate genetic instability of CTG·CAG repeats (PNAS, 2010);
- Genetic diseases caused by expandable repeats – dynamic mutations by Dr. István Balogh, Dr. János Kappelmayer, Dr. József Tőzsér (2011);
- HTT gene
- Epigenetic Regulation in Neurodegenerative Diseases;
- Histone modifications (Nature, Figure);