Шизофрения – «королева» психиатрии, где есть расхожая фраза о том, что разбираться в шизофрении значит разбираться в психиатрии. С другой стороны, есть генетика, в которой на базовом уровне уже давно необходимо разбираться не только каждому врачу, но и озадаченному своим здоровьем человеку. Хочется поженить две эти темы.
Шизофрения будет в конце. Выводы тоже.
Менделевское наследование и неоднозначность интерпретации результата
Генотипирование становится более доступным, к нему чаще прибегают врачи. Вопрос корректной интерпретации при этом остается. Менделевское наследование мы понимаем хорошо, но даже там все неоднозначно. Речь пока пойдет о том, когда 1 ген определяет черту.
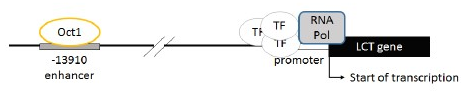
Давайте вспомним, недавно тут обсуждаемую неперсистентность лактазы.
Отрицательный тест не означает неперсистентность лактазы и проблемы с молочкой. -13910T (вариация enhancer части LCT гена) – это далеко не единственная мутация, подарившая людям восприимчивость молочной продукции во взрослой жизни. А в вашей лаборатории «у дома» с большой вероятностью будет генотипирование только по -13910T. Также наличие этой полезной для переработки молочной продукции мутации не означает отсутствие проблем с молочной продукцией. Есть те же DPP4 ферменты, например.
В этом плане генотипирование черт с менделевским наследованием – дорогой способ подтверждения уже известных черт наблюдаемого фенотипа. Но результаты надо уметь интерпретировать и сопоставлять с пациентом.
Пенетрация. Будет ли ген выражен или не будет выражен. Допустим, Серповидноклеточная анемия – зависит от мутации в одном гене. Но у этой мутации неполная пенетрация, 60%. То при наличие патологической мутации sickle cell anemia будет только в 3 случаях из 5. Наши гены находятся не в изоляции, принято считать, что различные генетические аспекты могут играть роль вкл/выкл даже при наличии патогенной мутации.
Экспрессия. Когда черта проявляется частично под действием генетического окружения и среды. Синдром Жильбера. У носителей (как я) повышенный билирубин. Но у меня он почти в норме или в норме, в самых трудных моментах уходя за 30, при острых кишечных инфекциях (допустим, ротавирус) за 40, а у других носителей билирубин редко опускается ниже 40.
Короткие выводы:
- Даже при менделевском типе наследования генотипирование накладывает определенные требования к умению врача интерпретировать результат и правильно доносить результаты до пациента;
- Всегда надо помнить про пенетрацию и экпрессивность;
Common traits (распространенные черты) запутывают картину еще сильнее
Менделевские черты относительно редки и как правило очень значимо влияют на здоровье. На common traits обычно влияет пул генов и среда.
Теперь давайте возьмем распространенную болезнь. Это заболевания/черты, которые встречаются часто, но обладают low effect size, то есть гораздо слабее медлевских черт влияют на патогенез.
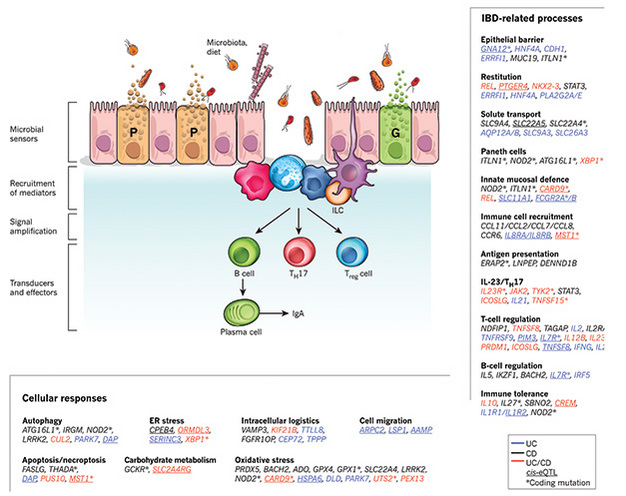
Посмотрите на болезнь Крона как пример. На текущий момент идентифицировано более 140 генов (а точнее loci), влияющих на болезнь Крона [1].
Когда обычный человек проходит генотипирование или даже секвенирование ДНК, то может получить информацию о риске х2/х4 развития той или иной болезнь. Шизофрения имеет распространенность 1% и абсолютный риск для среднестатистического индивида – 1%. Много ли будет значить риск х2 при отсутствии каких бы то ни было признаков и семейной истории психических расстройств?
Дело в том, что пул loci, которые будут влиять на предположительный риск развития заболевания определяет сама исследовательская компания. Поэтому этот риск может быть оценен по-разному.
И не стоит забывать про missing heritability. Возьмем рост белого человека как пример. 80% роста европейского человека определяются генетически (у азиатов 60%). При этом известными нам генетическими вариациями мы можем объяснить только 30% наследуемости. Остальные 50%, которые принято считать генетическими, но невозможно объяснить существующими вариациями и называются missing heritability.
В итоге получаем, что оценка генетических рисков распространенных заболеваний находится в младенческом состоянии и любые результаты вне клинической картины конкретного пациента значат очень мало.
GWAS как свет в конце туннеля
Genome-Wide Association Studies – это способ поиска патогенных мутаций. Методика молодая, существует с 2007 года.
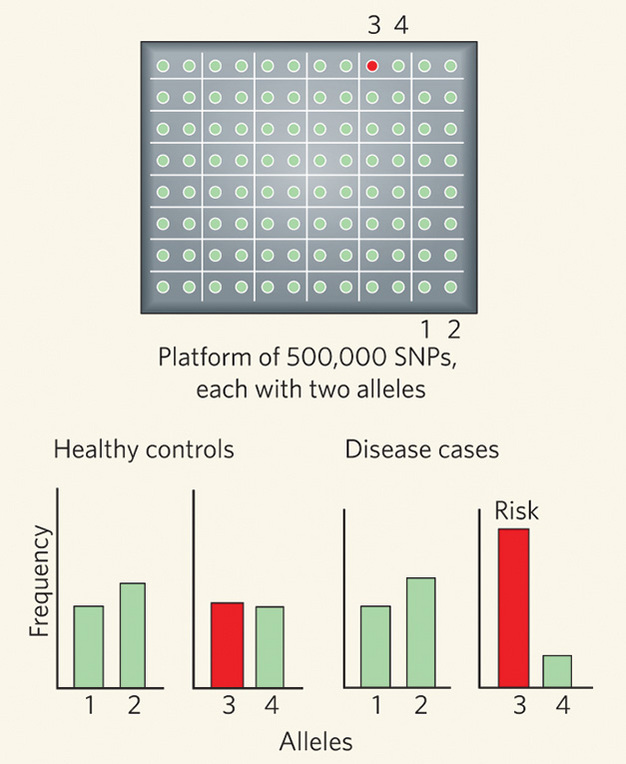
В исследованиях сравнивают 2 когорты: здоровых и больных людей. Затем статистическими методами определяют «значимость» той или иной мутации для конкретного заболевания.
По итогу GWAS анализа мы получаем Manhattan Plot, который назван так в честь того, что самые статистические вероятные кандидаты возвышаются как небоскребы Манхэттена.
Как пример шизофрения.
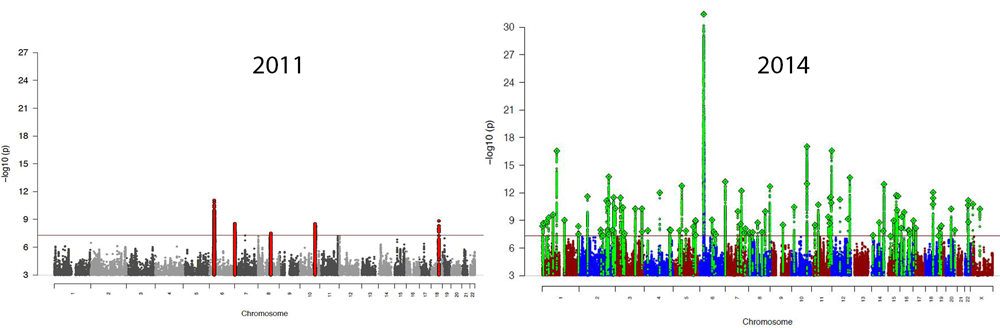
Как видите, работа по поиску патологических вариаций занимает года. И если мы посмотрим на мутацию, которую нашли в 6 хромосоме, то статистически это всего лишь +0,25% риска заболевания. Несколько лет и вместо 1% мы можем диагностировать 1,25%. Стоило ли оно того?
Шизофрения как аутоиммунное заболевание
Такие находки дают нам бесценные инсайты о понимании патофизиологии той или иной болезни. Возьмем в пример PCSK9 ген 1-ой хромосомы, роль которого обнаружили похожим способом. Этот ген кодирует одноименный фермент, крайне важный для метаболизма холестерина. И вариации в этом гене были обнаружены у людей, обладающим от природы очень низким холестерином. На основе этой находки появились клинические испытания лекарств, снижающих холестерин (не статины, на всякий случай). И хотя большинство этих разработок не дойдут до полки – GWAS в правильных руках даёт нам возможность искать инсайты о причинах болезней.
Психопатологию многие по недомыслию называют «почти наукой», а клинических психологов «почти врачами». Да, с одной стороны мы диагностируем пул клинических признаков, которые наблюдаем в течение продолжительного времени. И на основе симптоматики, довольно примитивно понимая патофизиологию, начинаем лечение. Но такова история всей медицины. Зачастую со странными причинно-следственными связями, вроде лечения сифилиса ртутью. Хорея Гентингтона вполне реальна, но до идентификации unstable repeats в HTT гене (об этом подробнее в будущей статье про эпигенетику) могла быть причислена к таким же судо-диагнозам.
MHC ген. MHC/HLA «паспорта» людей
Шизофрения была связана с мутациями в MHC гене 6-й хромосомы. MHC он же HLA ген кодирует MHC белки, которые презентуют пептидные «сигнатуры» патогенов Т-клеткам и актируют их. Подробнее в недавней заметке.
У людей может быть более 5000 вариантов MHC/HLA «паспорта», где только HLA-B часть отвечает более чем за 2500 вариантов.
Наша иммунная система постоянно сканирует организм на предмет свой-чужой. И наша иммунная система обладает рядом защитных механизмов иммунной толерантности, делая так, что в норме Т-клетки не атакуют сам организм (клональное уничтожение само-реактивных клеток в тимусе) и B-клетки не вырабатывают антигены на себя (дополнительная рекомбинация в костном мозге).
И различие MHC/HLA «паспортов» – причина отторжения пересаженных тканей. Иммунная система видит «чужой» HLA-“паспорт” и начинает обезвреживать незваную ткань. По этой же причине почти невозможно пересадить раковую опухоль от человека к человеку, оставляя такую экзотику как передаваемые опухоли лица каким-нибудь более гомогенным в плане MHC/HLA тасманийским дьяволам.
В общем, если мы видим мутацию в MHC гене, то она скорее всего будет связана с функцией иммунной системы. Мне кажется факт того, что шизофрения может быть связана с дефектами иммунной системы уже безумно интересно.
Забегая вперед скажу, что шизофрения связана с дисфункцией комплиментарных белков C4. Хочу вкратце напомнить, что такое комплиментарная система.
Иммунные комплименты
Комплименты – это белки врожденной иммунной системы, дополняющие иммунный ответ тремя функциями:
- Способствуют дальнейшему росту воспаления;
- [Некоторые комплименты] опсонизируют (обоволакивают) патогены, делая их более доступными для фагоцитоза профильными иммунными клетами;
- Лизис (растворения в своей среде путем разрушения клеточных стен бактерий), за который отвечает C9 MAC (membrane attack complex).
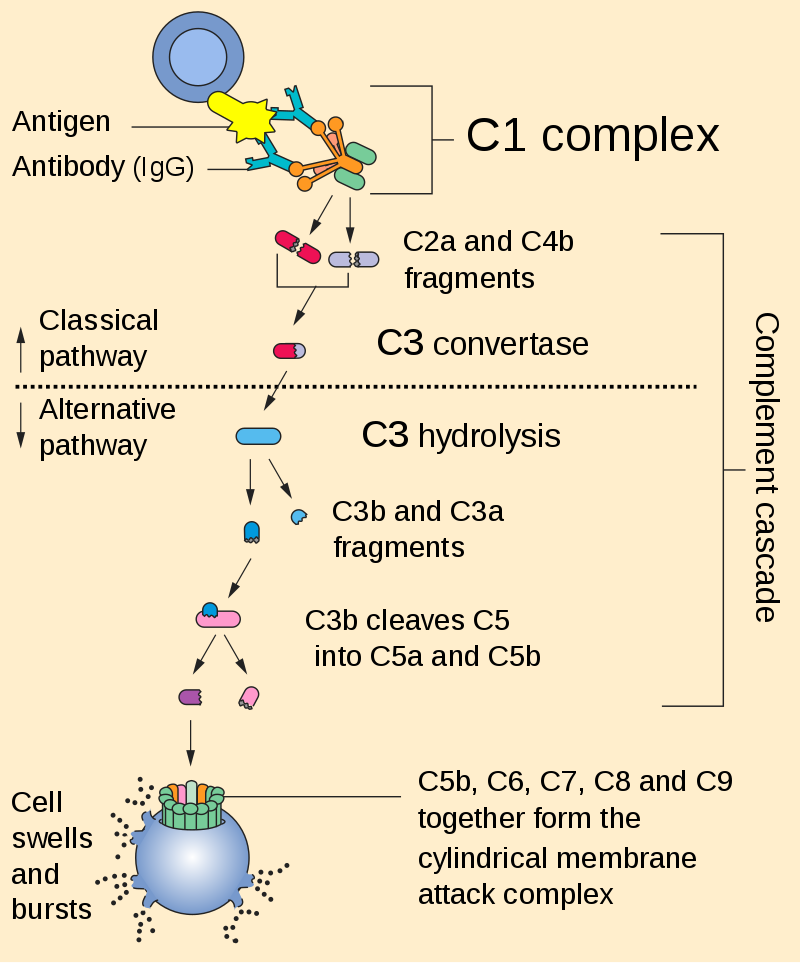
Картинка кажется перегруженной, но зато она охватывает все ключевые моменты.
Все начинается с:
- Контакта с микробами (альтернативный путь активации);
- Контакта с антителом (классический путь);
- Контакта с лектинами (агглютинины, связываются с определенными сахарами (допустим, маннозой), характерными для бактерий, в каком-то смысле естественные антитела.
При активации происходит Complement Cleavage (расщепление/разделение комплимента на части), основной путь:
- C3 расщепляется:
- C3a (способствует воспалению);
- C3b (опсонизация микробов);
- C3B расщепляет С5:
- С5a (воспаление);
- C5B активирует C9;
- C9 и с рядом других комплиментарных белков формируют Membrane Attack Complex, которые делает дыры в микробах, чем их напрямую убивает (лизис).
Комплиментарный каскад – важная часть функции врожденной иммунной системы. Давайте уже подойдем к вопросу причем тут шизофрения.
Шизофрения, синаптический прунинг и C4 белки
Синаптический прунинг – это выборочная «обрезка» синаптических связей нейронов, которая происходит с раннего детства до конца пубертатного периода. С возрастом количество нейронов не увеличивается. Но меняются синаптические связи, происходит миелинация аксонов и растут нервные волокна. По сути синаптический прунинг отражает процесс обучения человека (да и любого млекопитающего). Какие-то связи устанавливаются, какие-то крепнут, какие-то уничтожаются.
C4 белки комплиментарной системы связаны с синаптическим прунингом. Сильно упрощая картину я бы сказал, что C4 связаны с «пометкой» синапсов для уничтожения. С4 активирует C3, C3 ковалентно присоединяется к «целям» иммунной системы, которые в последствии уничтожаются фагоцитами. Также C3 «метки» необходимы для уничтожения синапсов микроглиями, важными клетками ЦНС, у которых есть рецепторы комплиментарных молекул [4,5].
C4 наиболее представлен в префронтальной коре и гиппокампе.
Из сотен полиморфизмов с шизофренией сильнее всего был ассоциированы 7751 различных вариаций MHC локуса [3]. Исследование впечатляет своими масштабами. Анализировались данные 28 799 пациентов с шизофренией и 36 986 контрольных пациентов, 40 когорт в 22 странах [3].
Шизофрения (да и аутизм) отличается чрезмерно активным сипаптическим прунингом, большей выраженностью C4 белков.
Это, на мой взгляд, и позволяет говорить, что шизофрения – аутоиммунное заболевание. Комплиментарная система помечает для удаления гораздо больше, чем это бы следовало, в итоге мешая корректному прунингу (то есть научению) и приводя к странным гомологическим связям нейронов и как следствие к некорректной работе функции отражения окружающей действительности.
Плюс этой находки в том, что уже сейчас мы можем создавать моноклональные антитела почти для чего угодно. Очевидно, что это не всегда так просто работает, может быть ряд сложностей. Но генетика (и конкретно GWAS) помогла нам найти этот важный инсайт о болезни, который может быть отправной точной нового подхода к лечению этого тяжелого недуга.
Выводы:
- Даже такая тривиальная вещь как генотипирование SNP требует базового понимания генетики;
- Никто не стоит забывать не только про самого пациента, но еще и про пенетрацию и экспрессивность;
- Оценка риска распространенных болезней (common diseases) пока находится в незрелой фазе. Болезни часто определяются сотнями loci и факторами среды, причем лаборатории сами определяют какие мутации они включают в пул, какие нет;
- GWAS – методика, которая сравнивать здоровую и больную когорты, и статистическими методами находить патогенные мутации, в которые исследователи в будущем могут «зарыться»;
- Шизофрения связана с множественными полиморфизмами MHC гена на 6 хромосоме, который играет очень важную роль в работе иммунной системы;
- Шизофрения связана с гиперактивной функцией комплиментарных белков C4, которые участвуют в синаптическом прунинге, активируя уничтожение тех или иных синапсов.
Источники:
- Finding Genes for Common Diseases Using GWAS;
- Schizophrenia’s Genetic “Skyline” Rising;
- Schizophrenia risk from complex variation of complement component 4;
- The Classical Complement Cascade Mediates CNS Synapse Elimination;
- Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner;
- Genetics of Schizophrenia: Overview of Methods, Findings and Limitations