Метформин. Снижение тестостерона и различие реакций на лекарство у разных фенотипов пациентов


Podcast: Play in new window | Download
Subscribe: Apple Podcasts | RSS
Говорим о кето, тренировках, митохондриях, работе со своей психикой.
Дмитрий – хорошо известный в “кето-тусовке” человек с огромным количеством знаний по диетам, тренировкам, изменению себя. Все, кто пересекается с Дмитрием какое-то время, знают, что он неиссякаемый источник глубоких озарений по целому ряду важных тем.
На текущий момент он консультирует на людей по темам похудания, кето-диеты, тренировкам – выполняет сложную, но столь необходимую фукнцию наставника.
Глюконеогенез – процесс превращения амино-кислот и глицерина в глюкозу. С ростом популярности кето-диеты хочется уделить время тому, почему кето – не волшебная диета, а имеет ряд ограничений.
Если сумма потенциальных энергий конечных продуктов реакции сильно меньше чем изначальных реактантов, то реакцию принято считать необратимой. У нашего организма есть обходные пути синтеза нужных молекул, но это энергонеэффективный процесс. Для восстановления молекулы глюкозы организм затратит заметно больше энергии, чем может извлечь из нее. Зачем же нам тогда глюкоза?
Я уже касался этой темы более подробно в заметке про глюкозу и мозг. Жировые кислоты могут быть использованы только для получения энергии и ее запасания в виде жира. Глюкоза – это еще и строительные углеродные блоки для поддержания целостности белкового тела, и источник (через пентозо-фосфатный путь) NADPH для восстановительных реакций и рибозы (строительного блока нуклеиновых кислота).
Наивно думать, на мой взгляд, что склонять организм к энергонеэффективному процессу продолжительное время можно без последствий.
Оксалоацетат – промежуточное звено цикла Кребса. Проблема в том, что оно истощается не только самим циклом лимонной кислоты, но и глюконеогенезом, и синтезом амино-кислот.
Еще в 1946-м году Ленингер (Lehninger) показал, что рост кетоновых тел обратно-пропорционален уровню оксало-ацетата [1].
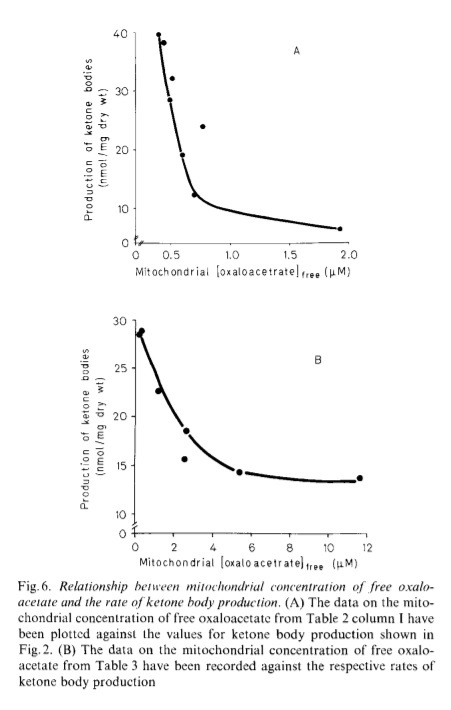
Больше кетонов значит ниже глюкоза, значит активнее должен протекать глюконеогенез.
Преобразование пирувата в оксалоацетат (ступенька восстановления глюкозы, сам пируват несложно получить из амино-кислот и других компонентов цикла Кребса) катализирует пируват карбоксилаза. Пируват карбоксилазу а кортикостероиды, глюкагон (считайте дефицит глюкозы) и катехоламины.
Катехоламины – это дофамин, адреналин, норадреналин. Сигналы, посылаемые нервной системой. В принципе это способ нашей нервной системы «поддать газу» на глюконеогенез.
Кето-диета имитирует голод. На молекулярном уровне в том числе. Она активирует симпато-адренальную систему [3, 4]. Проще говоря, активируется часть нервной системы, отвечающая за стресс.
Предполагаю, что своеобразное и очень интересное ментальное состояние на кето – результат работы не только кетоновых тел, но и катехоламинов. Также напрашивается частичная аналогия с некоторыми антипичными антидепрессантами вроде бупропиона.
Хронический глюконеогенез будет связан с цАМФ. Циклические молекулы в биохимии являются частью системы second messengers. При недостатке глюкозы поджелудочная будет выбрасывать вместо инсулина глюкагон. Гормон – экстраклеточный сигнал. А second messengers – это клеточные молекулы, активируемые внешним сигналом, которые амплифицируют (усиливают) изначальный сигнал и проделывают еще какую-то работу.
цАМФ связана с модулированием функции Т клеток [5].
Циклические молекулы (цГМФ и цАМФ) приводят к высвобождению гладкой мускулутарой кальция. И в последующем к эрекции. Повышенный уровень цАМФ на кето могут помочь людям, чья невозможно поддержать эрекцию связана с функцией цГМФ. Анекдотические случаи уже есть на кето.
Однако циклические молекулы имеют и обратную сторону. Они могут при некоторых обстоятельствах приводить к сужению сосудов [6] (а не только способствовать их расширению и улучшению микроциркуляции).
В целом роль цАМФ скорее положительная. Например, сдвиг митохондрий в сторону окислительного метаболизма [7]. Но роль цАМФ многогранна, а в рамках дилеммы плохо/хорощо двояка.
В свое время я показывал, что кето-диета приводит к обратимой деградации комплекса I митохондрий. Что схоже с эффектом метформина и даже имеет с ним синергетичный эффект.
Это может быть полезно для ряда метаболических заболеваний. Но довольно вредно для фертильности и уровня анаболических гормонов. Снижение тестостерона на метформине – известная проблема.
Отсюда большое противоречение про кето и тестостерон. «Больше холестерина – больше тестостерона» – несколько нерабочий слоган. Клетки Лейдига с подавленным 1-ым комплексом будут производить больше тестостерона или меньше? Даже при избытке холестерина.
Про митоходрии, близость и работу комплексов и важности всего этого для фертильности я уже писал.
Эффект Варбурга – это предпочтение гликолиза даже в условиях избытка кислорода – один из метаболических признаков рака.
Проблема в том, что ряд нормальных клеток полностью или в основном гликолитичны: клетки Мюллера (глаза), стволовые клетки, лейкоциты, часть клеток выделительной системы.
При избытках кислородных радикалов стволовые клетки дифференциируются (+/- контекстуальны). И отчасти по этой причине есть известное противоречие кето и рака почек / мочевыводящих путей.
Значит эффект Варбурга то, что к кето надо подходить осмысленно. Четко понимая каких целей мы хотим достигнуть и какие риски нас могут ждать.
Кетоны – метаболические кислоты. Кислотность (водород) от углеводов выводится легкими за минуты. Кетонов и жиров – почками в течение недель. Подробнее в одной из прошлых заметок.
Опуская то, что вы можете прочитать в другой заметке, кето снижает pH почти. В 30х (до эры антибиотиков) кето использовали для снижения pH мочи, для эрадикации бактерий урогенитального тракта [9].
В России нет теста крови на бикарбонат. Мы не может контролировать Anion Gap и метаболический ацидоз через кровь (организм от него будет восстанавливаться неделями). Нужно контролировать pH мочи. При необходимости добавляя источники бикарбонатов.
Желчь выбрасывается при поедании жирной пищи. С удаленной желчью кето – норма. Такая глубина анализа подходит, если у вас сектантское мышление или если вам недавно провели интернет, но еще не научили искать информацию и критически ее анализировать.
Кето – метаболическая кислота. Гастроэнтерологи советуют завтрак овсянкой как способ уменьшить химический урон стенках желудках, на которые и придется основной урон от дисфункций связки печень – желчный пузырь.
Кето ухудшает симптоматику ГЭРБ.
Кето приводит к росту билирубина. Привет людям с болезнью Жильбера
И многое другое. Суммировал информацию традиционно Джон Бриссон.
When Excess Fat in the Diet Can Cause Digestive Issues and How to Improve Fat Digestion
Ketogenic Diets, Effects On Your Gut and Health and How To Follow Them
Кето-диета имитирует голодание. На очень многих уровнях. И всегда ли долгосрочное псевдо-голодание хорошо? Конечно же нет.
Пример 1. У нас пациент с депрессией после развода, который не реагирует на СИОЗС, но хорошо реагирует на бупропион (поднимает дофамин и норадреналин). Кето-диета может полноценно заменить антидепрессант. При дополнении кето поведенческой терапией и другой поддерживающей терапией (d3, окситоцин интраназально итд) может спасти пациента от нежелательных явлений/
Пример 2. У нас пациент с явными митохондриальными дефектами. У нас в арсенале кето и гипер/гипо окситерапии, который помогут уничтожить дефектные митоходрии. Но нам обязательно нужно дополнить подобную терапию интервенциями, которые приведут к росту митохондрий (PQQ. Тренировки тела/ума на это итд). Или мы можем рассмотреть молекулы переносящие электрон с 1 на 3 и с 1 на 4 комплексы (ибеденон, метиленовый синий).
Пример 3. Пациент с 4-й месяц кето говорит о симптомах симпатического тонуса. Плюс пациент начинает быстрее свирепеть. При курильщиках, например. Возможно, проблема в сужении сосудов из-за катехоламинов.
Пример 4. У пациента семейная история болезней желчного пузыря и синдром Жильбера. На кето вырастит билирубин и появятся/усилятся симптомы синдрома. Кето может усилить/актуализировать проблему «перетяжки» желчного пузыря, приведя к ГЭРБ и повреждению желудка. Вероятно, стоит продумать поддерживающие терапии или отказаться от кето (в зависимости от целей/пациента).
Пример 6 Мужчина с хроническим простатитом. Кето снизит pH в мочевыделительной системе, делая простату менее доступной для иммунных клеток (которые тоже белковые тела и их функция зависит от pH), кето может негативно повлиять на симптоматику за счет сужения сосудов и, возможно, неоднозначной роли на гликолитичные клетки.
Пациент 7. Девушка до 30, которая хочет забеременеть в первую очередь, во вторую – немного улучшить метаболическое здоровье. Скоро поедет отдыхать. Кето ей не нужно. Есть альтернативные стратегии.
Мочевая кислота – продукт метаболизма пуриновых нуклеиновых кислот. У кето-общественности есть озадаченность в связи с ростом мочевой кислоты на кето. Что и является поводом для написания этой заметки.
Очень прошу не путать метаболизм мочевины (urea) и метаболизм мочевой кислоты (uric acid). Мочевина – способ выводить побочные продукты метаболизма аминокислот и важный компонент гомеостаза почек. Не смотря на созвучие и родственную связь, роль молекул очень сильно разнится. Классический пример спутывания теплого с мягким.

Существует 2 разновидности нуклеиновых кислот (структурных компонентов ДНК):
Аденин + рибота + фосфатные группы – это АМФ, АДФ, АТФ, которые представлении не нуждаются.
Кето-диета тут вот причем (к сожалению, будет только база и ничего нового):
Жиры – более восстановленная форма углерода, чем углеводы. Жировые кислоты можно сильнее окислить и извлечь больше энергии, но с большими затратами кислорода. Жиры – прекрасный способ запасть энергию, потому что их хранения не нужна вода (в отличие от гликогена). Очевидные недостатки жиры: создают проблему большего количества кислородных радикалов (именно поэтому длинноцепочные жировые кислоты укорачиваются в отдельных органеллах пероксисомах до попадания в митохондрии). И куда меньшая универсальность углеродной основы жиров по сравнению с глюкозой. Жиры могут быть запасены, могут отправиться в цикл Кребса и всё. Напрямую восстанавливать пируват или быть сырьем для нуклеиновых кислот они, в отличие от глюкозы, не могут.
Углеводы обладают своими достоинствами и недостатками, которые мы уже разбирали на примере глюкозы и мозга.
Возвращаясь к мочевой кислоте, жиры/кетоны – это больше АТФ на 1 атом углерода и больше реактивных видов кислорода.
АТФ (и ГТФ, получаемый в ходе цикла Кребса), как я вам напомнил, источники пуринов: аденина и гуанина.
Метаболизм на основе жиров/кетонов – больше АТФ/ГТФ – больше пуринов – больше мочевой кислоты [1, 2].
То есть на кето априори растет уровень мочевой кислоты.
Добивая эту тему, хочу напомнить, что кетоны – слабые кислоты, они снижают pH относительно оптимальных физиологических значений. Окисление мочевой кислоты катализирует фермент уриказа (см рисунок выше). pH меняет конформацию белков, более низкий pH – более закрытая конформация белков/ферментов.
Кетоны как слабые кислоты могут угнетать функцию уриказы, окисляющей мочевую кислоту, за счет снижения pH и смены ее конформации [3].
И также довольно базовый механизм биохимической негативной регуляции – ксантин подавляет активность уриказы [4, 5] (см рисунок выше).
Рост мочевой кислоты на кето – совсем не повод искать у себя симптомы подагры.
Подагра – тяжелая болезнь, связанная накопление в тканях (первую очередь суставах) мочевой кислоты. В моем понимании, это в основном генетическая болезнь, связанная с патогенными вариациями генов, кодирующих уриказу. Я предлагаю исходить из того, что мы говорим о физиологической норме и рассуждаем о потенциальных причинах, механизмах, плюсах и минусах роста молочной кислоты на кето.
Для наступления просветления в отдельно взятой теме я рекомендую статью Бенхарда Беккера «О физиологической роли мочевой кислоты» далекого 1993-го года [если вы мне напишете, я, конечно же, ни за что вам не вышлю полный текст статьи в pdf ;)].
Беккер напоминает нам, что у большинства млекопитающих основные метаболиты пуринов в крови – это аллантоин и мочевина. И что их уровни мочевой кислоты меньше 10% человеческого уровня. Что уже ставит вопрос: это случайная генетическая вариация, которая нас не убила, или всё же у повышенной концентрации мочевой кислоты есть свои плюсы?
Основной аргумент статьи Беккера, который он умело доказывает, что мочевая кислота и ураты (ее соли) – мощные антиоксиданты.
Мочевая кислота ответственна за нейтрализацию 30-65% всех пероксильных радикалов плазмы. Причем мочевая кислота и ураты находятся как в плазме, так и внутриклеточно, что говорит об их универсальности. Более чем уместно будет ставить ее в один ряд с глутатионом и супероксид дисмутазой.
Помните, что я писал о жирах и кислороде чуть выше? Сжигание жиров – больше кислорода. Больше кислорода – больше кислородных радикалов. Хорошо ли при повышенных кислородных радикалах (повышение которых в митохондриях профильных нейронов гипоталамуса, к слову, дает нам чувство сытости на кето) иметь повышенные уровни антиоксиданта для баланса? Я думаю, что неплохо.
Мое мнение, что повышение мочевой кислоты на кето – это нормальный физиологический механизм, имеющий свои очевидные преимущества. Если ничего не беспокоит, то об этом не стоит думать.
В крови сильно повышена мочевая кислота (особенно у полных людей [7]) и есть симптомы, которые (как вам кажется) похожи на подагру. Вы идете к врачу. Врач при виде анализа мочевой кислоты подумает о камнях в почках (тот вид, где мочевая кислота есть) и подарге. Если скажете «кето», то вполне возможно посмотрит на вас, как на идиота. И вам врач выпишет вам симптоматическое лечение (допустим, НСПВП), диету с низким количеством пуринов и аллопуринол или подобный препарат. Ничего из этого не сделает вам здоровее.
Тут я вам хочу напомнить про фармакогенетику. Генотип HLA-B*58:01 будет иметь острую аллергическую реакцию на аллоупуринол [8], которая называется синдром Стивена-Джонсона (Steven-Johnson syndrome) и 10% шанс «сыграть в ящик».
Другие лекарства от подагры обладают не меньшими побочными эффектами. Этот риск оправдан и отчасти необходим больным с подагрой, и совершенно не оправдан для начинающего кетогенщика с болью в суставах (которые не факт, что вызваны мочевой кислотой).
И для душевного успокоения и снижения мочевой кислоты у нас с вами есть натуральные средства (еда и травки):
Pubmed, как говорится, в помощь. Да и кето – сезонная диета, со своими недостатками. В которой, на мой взгляд, не нужно находиться круглый год.
Кето – высоко жировая и низко-углеводная диета, имитирующая положительные эффекты голодания (активация оси NAD+ > Sirt1 > PGC-1α) без катаболической части. Я довольно много касался метаболической составляющей вопроса, неврологической и даже клеточных механизмов, а вот до иммунологии не доходило.
Т помощники (T helpers, Th далее) – это клетки адаптивной иммунной системы. Не менее корректный термин CD4+ (CD4 positive). Th активируются антиген презентующими клетками в во вторичных лимфоидных органах и помогают организму выработать ответ, специфичный патогену.
Патогены бывают разными, поэтому у CD4+ клеток есть свои подтипы, вырабатывающие свои клеточные химические сигналы:
Th1, основной цитокин интерферон гамма (IFN-γ), эти клетки связаны противодействием интрамолекулярным бактериям (например, Mycobacterium tuberculosis), которые умело противодействуют деградации и фагоцитозу, будучи внутри макрофагов; IFN-γ в том числе активирует функцию фагоцитоза, помогая «переварить» патоген;
Th2, основные цитокины: IL-4, IL-5, IL-13; Интерлейкин-5 активирует эозинофилы (гранулоциты), которые выпускают гранулы, помогающие уничтожать паразитов. IL-4 и IL-13 действуют на кишечник, увеличивая выработку мукуза (слизи) и увеличивают мотильность кишеника.
Th17, основной цитокин: IL-17; этот цитокин помогает сражаться с экстраклеточными патогенами (грибками, бактериями), привлекая в воспаленные ткани нейтрофилы и моноциты (в будущем макрофаги), которые их фагоцитируют. Также Th17 стимулирует клетки эпителия выделять так называемые дефенданты, естественные антибиотики, которые связываются с бактериями снаружи кожных покровов.
Все перечисленные выше цитокины – про-воспалительные и могут быть связаны с иммунными проблемами: будь то аутоиммунные заболевания (Th1, Th17) или аллергии (Th1, Th2).
Treg – это СD4+ клетки, регулирующие силу и продолжительность иммунного ответа. Чрезмерная активность Th1 может привести к образованию гранулём (куча МФ, окруженных Тh1 кольцом). Чрезмерная активность Th17 может привести к урону тканям, например.
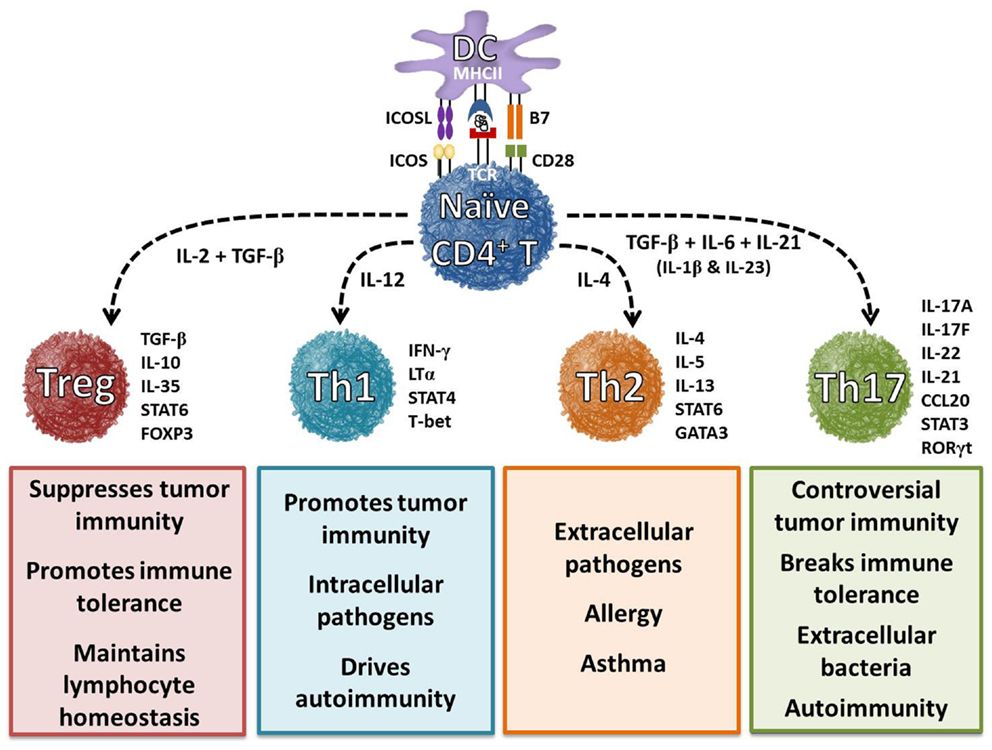
Первое же заболевание, которое ассоциируется с IL-17 – это, конечно же, псориаз. Другие заболевания, которые ассоциируются с IL-17: ревматоидный артрит, анкилозирующий спондилит (болезнь Бехтерева), болезнь Крона, рассеянный склероз и некоторые другие.
Довольно много шума наделал не так давно секукинумаб компании Новартис, моноклональное антитело к IL-17 (он же IL-17A). «Маб» в конце действующего вещества обозначает monoclonal antibody (моноклональное антитело), молекулы, связывающиеся с профильными антителами и влияющие на секрецию цитокинов.
С моноклональными антителами есть 2 большие проблемы:
Довольно часто оказывается, что среда, образ жизни и даже диета могут быть регуляторами иммунного ответа.
Давно не секрет, что летом шанс на ремиссию псориаза увеличивается. Витамин D подавляет производство IL-17 клетками Th17.
У кето есть схожий эффект, размеру на анализе статьи The effects of ketogenic diet on the Th17/Treg cells imbalance in patients with intractable childhood epilepsy.
Исследователи взяли 28 детей с эпилепсией неясной формы + контрольную группу.
До и после замеряли интересные маркеры воспаления.
После кето снизилось количество Th17 клеток и повысилось количество Treg.
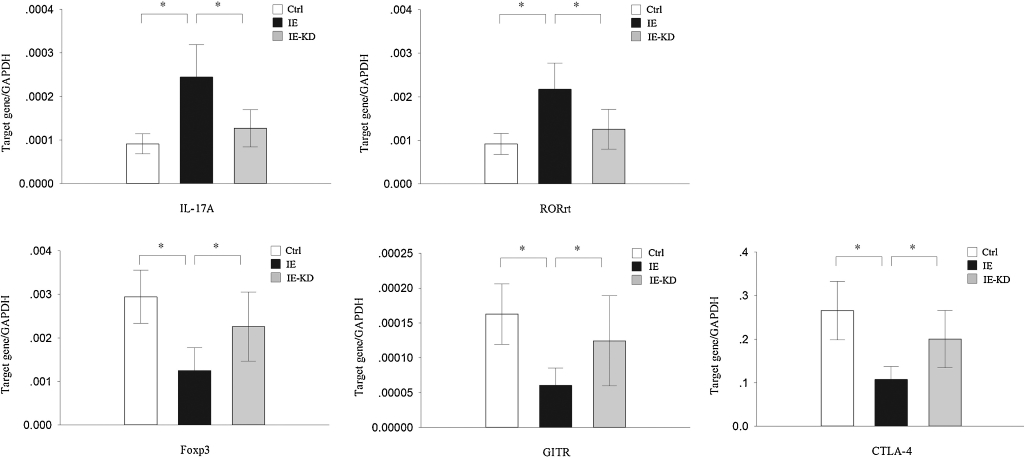
С более детальными маркерами не менее интересно:
IL-17A. Основной про-воспалительный цитокин Th17, его концентрация на кето у детей-эпилептиков заметно снизилась. Самый важный результат, позволяющий говорить о кето как о противовоспалительной диете.
Foxp3. Основной оркестрирующий белок Treg. Его рост на кето говорить об увеличении функции Treg.
RORγt. Транскрипторный фактор, важный для дифференциации Th17. Его снижение на кето – в большей части случаев можно расценивать противовоспалительный эффект.
GITR. Белок, который выражают Treg, растет на кето.
CTLA-4. Белок Т-клеток, связывающийся с дендритными клетками таким образом, чтобы те, не могли активировать Т-клетки. Подробнее в профильной заметке. Больше CTLA-4 – больше деактивации и анергии Т-клеток.
Подавление IL-17A, RORγt – цели фармакологический терапий для аутоиммунных заболеваний.