Кетогенная диета – высоко жировая диета, когда большая часть органов и мозга начитают питаться не глюкозой, а жировыми кислотами и кетонами. Коппел и Свердлов опубликовали в журнале нейрохимии обзорное исследование «Нейрокетотерапия: современный взгляд на вековую терапию». Как всегда, в конце выводы для тех, кому не очень интересно читать нюансы биохимии.
История кетогенной диеты
Еще Гиппократ рекомендовал лечить эпилепсию голоданием. Исторически было хорошо известно, что продолж

ительное голодание снижает частоту и силу припадков. Вспомните картину «Преображение» Рафаэля, где справа внизу картины нарисован мальчик, у которого заканчивается приступ. Можно только поражаться мастерству Рафаэля, потому что он изобразил мальчика, выходящего из конвульсий, то есть исцеленного. Это эпизод из 17 главы Евангелия от Матфея, как раз где есть по-библейски глубокая фраза «если вы будете иметь веру с горчичное зерно и скажете горе сей: “перейди отсюда туда”, и она перейдет; и ничего не будет невозможного для вас». К Иисусу подошел мужчина и попросил исцелить «бесноватого» отрока. Иисус его исцелил, а на вопрос как ответил: «сей же род изгоняется только молитвою и постом». Традиционно это считается описанием лечения эпилепсии.
Кетогенная диета появилась как имитация эффектов голодания на эпилепсию, но без сильно
катаболической части, которая неизбежно сопровождает продолжительное голодание.
С изобретением антиконвульсантов популярность кетогенной терапии сначала упала, но с 90-х ее популярность начала возвращаться. Был даже снят телефильм «Не навреди» о ребенке-эпилептике, не реагирующим на лекарства. Сейчас кето-диета используется в первую очередь для лечения устойчивой лекарствам эпилепсии, для снижения дозировок и, соответственно, снижения побочных эффектов антиконвульсантов (вроде вальпроевой кислоты).
Кетогенез
У млекопитающих к кетозу приводит продолжительное голодание. В результате снижается концентрация инсулина в крови и повышается концентрация глюкагона. Активность глюкагона приводит к гликогенезу (расщеплению гликогена до глюкозы) и глюконеогенезу (синтезу глюкозы из белков и в меньшей степени жиров). Снижение инсулина способствует липолизу белой жировой ткани, что приводит к увеличению концентрации жировых кислот и бета-оксидации.
Бета-оксидация жировых кислот происходит в печени, где создается много ацетил-КоА. Как только количество ацетил-КоА начинает превышать способности цикла Кребса его «переработать», ацетил-КоА уходит на другие нужды: синтез холестерина или кетогенез.
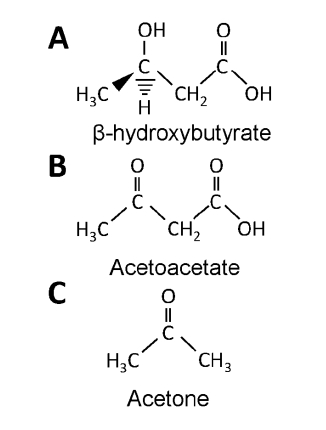
2 молекулу ацетил-КоА объединяются ферментом тиолазой в ацетоацетил-КоА. Затем добавляется третья молекула ацетил-КоА и получается бета-гидрокси-бета-метилглюкарил-КоА (HMG-CoA), реакция проводимая ферментом HMG-CoA синтазой. Реакция HMG-CoA синтазы – ограничивает скорость химической реакции в кетогенеза. HMG-CoA лиаза освобождает две углеродные группы с созданием одной молекулы ацетил-КоА и одной молекулы ацето-ацетата. Ацето-ацетат – первое кетоновое тело, создаваемое во время кетогенеза. Далее ацето-ацетат восстанавливается с помощью NADH и бета-гидроксибутират дегидрогеназы 1 (BHD1) до самого распространенного кетонового тела в нашем организме – бета-гидроксибутирата. Схематически это отображено на рисунке ниже.

Дефицит HMG-CoA лиазы предотвращает кетогенез. При продолжительном голодании дефицит этого фермента приводит к патологическому состоянию гипогликемии и низкой концентрации кетонов одновременно. Это состояние часто ассоциируется с приступами.
Небольшая часть ацетоацетата без участия энзимов теряет углеродные группы (декарбоксилирование) и превращается в ацетон. Ацетон токсичен в больших количествах. В печени конвертируется через метилглиоксальный путь. Так как ацетон крайне летучий, то есть уровень его производства превышает способность печени его конвертировать, то он выделяется через дыхательную систему. В итоге ацетон не достигает заметной концентрации во время кетогенной диеты или голодания.
Синтез бета-гидроксибутирата (BOHB) и ацетоацетата дает 2 молекулы ацетил-КоА и оксидацию NADH.
Кетоны в организме синтезируют гепатоциты и астроциты. В ответ на повышение жира в диете астроциты начинают синтезировать кетоны, обратная связь через вентромодальные нейроны гипоталамуса. Напомню, что есть астроцито-нейронный лактатный шатл (ANLS), когда астроциты перерабатывают глюкозу в лактат и отправляют его в нейроны. Вспоминайте идеи Добромыльского.
Кетолиз
После синтеза в печени монокарбоксильные кислотные транспортеры высвобождают кетоны в кровь, и те становятся доступными органам. После пересечения ГЭБ [транспортеры] MCT 1 и 2 доставляют кетоны в астроциты и нейроны соответственно. Кетоны протаскиваются через цитоплазму в митохондрии, где их и перерабатывают. Переработка кетонов похожа на обратный порядок их создания, но есть некоторые отличия.
В частности, для расщепления ацетоацетата нужен фермент сукцинил-КоА:3-кетокислота трансфераза (SCOT). В гепатоцитах печени отсутствует этот фермент. Гепатоциты печени могут создавать, но не могут потреблять кетоны. Что и объясняет особую роль в печени в кетогенезе.
Схема расщепления кетонов указана на рисунке выше. Все заканчивается в цикле Кребса и дыхательной цепи переноса электронов.
Кетоны сами по себе подавляют гликолиз и стимулируют окислительное фосфорилирование. Так как окисление бета-гидроксибутирата до ацетоацетата сопровождается восстановлением NAD+ до NADH, это само по себе питает комплекс 1 и снижает потребность в глюкозе.
Также кетоны доставляют углерод в цикл Кребса, тем самым повышая его анаплероз (наличие субстратов для каскадных реакций цикла).
Кетоны способствуют синтезу гамма-аминомасляная кислоты (GABA) из глутамата. Также ацетил-КоА в соединении с холином (допустим, из яиц) приводит к синтезу ацетилхолина. Поэтому кетоны влияют не только на биоэнергетику, но и на уровень нейротрансмиттеров.
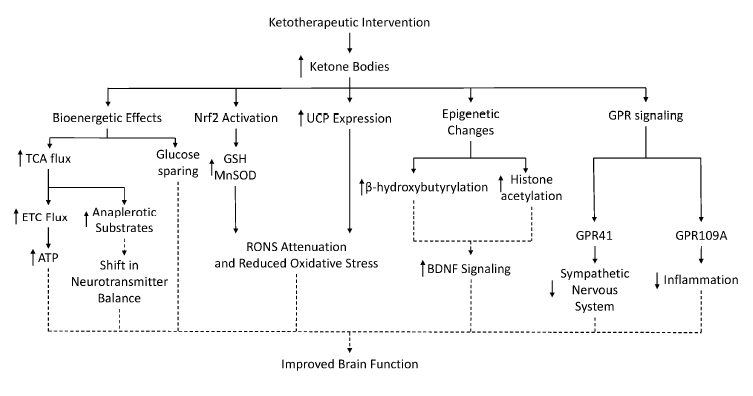
Кетоновые тела и функция митохондрий
Кетогенная диета усиливает экспрессию белков дыхательной цепи и разобщающего белка 1 (UCP 1, термогенин). Что способствует «бурению» жировой ткани, переключая поток электронов с создания АТФ на генерацию тепла. Также повышенная вытечка протонов в матрикс смягчает генерацию реактивных видов кислорода и азота, позволяя избегать гиперполяризации.
Экспрессия UCP4 и UCP5 увеличилась у крыс в 1,5 раза во время кетоновых добавок. У нейронов экспрессия UCP4 была наиболее сильна, у астроцитов наименее. Кетогенная диета повышает экспрессию UCP4 и UCP2 в гиппокампальной зубчатой извилина крыс, что защищало животных от негативных эффектов химических ингибиторов комплекса 1 и комплекса 2.
Если коротко, то кетоны имеют нейрозащитный эффект с помощью повышения экспрессии разобщающих белков (UCP). Предположительно в этом задействован сигнальный путь Nf-Kb (эн-эф-каппа-би) и увеличенное производство АТФ через поток электронов на комплекс II.
Кетогенная диета воздействует на RONS не только регуляцией экспрессии разобщающих белков. У крыс через 3 недели кето-диеты повышался уровне глутатиона (мощный клеточный антиоксидант). Предположительно за счет влияния на фермент глутамат цистеин лигазу (GCL), чье количество ограничивает синтез глутатиона.
Относительно самих реактивных видов, как помните, кетогенная диета изначально повышает их производство, что активирует сигнальные пути реакций на оксидативный стресс (Nrf2).
Кето-диета питает различные белковые структуры, что в одном из исследований приводило к росту количества митохондрий в гиппокамальной зубчатой извилине крыс. Хотя не совсем ясно за счет чего это произошло: усиление биогенеза митохондрий, снижения митофагии, комбинации обоих или чего-то еще.
Кетоновые тела и посттрансляционная модификация белков
Бутират способствует ацетилированию гистонов. Повышенные уровни бета-гидроксибутирата подавляют гистон деацетилазы 1, 3 и 4 и повышают ацетилирование гистоновых «хвостиков». Ацетилирование усиливает экспрессию генов, связанных с FOXO3A (фоксо три) белком. Нарушения функции этого белка связаны с туморогенезом, ростом опухолей. Один из генов, зависимых от FOXO3 – тот, которые регулирует активность марганец супероксид дисмутазы (MnSOD) и каталазы, которая дисмутирует О2 супероксид.
Также кетоны модифицируют остатки лизина со схожим эффектом.
Кетоновые тела и экстраклеточные сигналы
Помимо усиления сигнальной экстраклеточной функции, BOHB может функционировать как экспраклеточный рецепторный лиганд. В частности, BOHB является агонистом HCA2-рецепторов, они же GPT 109A. Опуская детали, это приводит к подавлению сАМФ (циклический аденозин монофосфат), который связан с производством про-воспалительных цитокинов. Грубо говоря, кетогенная диета обладает противовоспалительным эффектом, что экспериментально подтверждено и есть понимаемый механизм этого эффекта.
Также бета-гидроксибутират является агонистом GPR41 рецептора (он же FFA3). Что подавляет активность симпатической нервной системы, в основном в симпатических ганглиях.
Кетогенная диета и BDNF
Кето-диета усиливает экспрессию нейротрофического фактора мозга (BDNF). То есть способствует пролиферации старых и развитию новых нейронов, синаптической пластичности и синаптических связей. BDNF активирует целую цепочку сигнальных путей, которые способствует здоровью наших нейронов. Подробнее в тексте исследования, а то я боюсь потерять немногочисленную аудиторию, которая дочитала до этого места.
Кетогенная диета и неврологические болезни
Кетоны и развитие ЦНС
Кетоны играют критически важную роль в развитии мозга. Окисление кетонов начинает во время развития плода. Материнское молоко кетогенное, так как содержит большое количество средне цепочных триглицеридов (MCT). Значительная часть энергопотребности мозга младенца «закрывается» кетонами. Блокировка кетогенеза усиливает припадки у щенков крыс.
Кетоны – основной субстрат синтеза жиров в период резкого роста мозга.
Эпилепсия
Эпилепсия включает в себя аберрантную синхронную деполяризацию нейронов ЦНС. Обычно проявляется как пароксизмальные нарушения сознания и моторной функции. Терапевтический механизм кето-диеты во время эпилепсии продолжает быть спорным, не смотря на вековую историю применения.
Кетогенная диета повышает концентрацию GABA и снижает активность глутамата (преобразуя его в GABA). То есть мы говорим о снижении экзитотоксичности (exitotoxicity) глутамата.
Также в эпилепсии играют роль чувствительные к АТФ калиевые каналы (ATP-sensitive potassium channels). Повышенный синтез АТФ в кетозе может воздействовать на эти каналы, влияя на поляризацию мембраны.
Нейроны черного вещества базальных ганглий гораздо реже «выгорали» в присутствии BOHB и ацето-ацетата.
Также кетоны взаимодействуют с PPAR-гамма-2 рецептором, «модной» целью эпилептических разработок.
Болезнь Альцгеймера
Внутриклеточные тау-нейрофибрильные сплетения, накопление амилоид-бета бляшек, смерть нейронов, дисфункция митохондрий, гипометаболизм глюкозы – отличительные гистологические признаки болезни Альцгеймера.
Подавление функции белков дыхательной цепи коррелирует с накоплением амилоидных бляшек.
В общем кетоны частично помогают с этими проблемами. Лучше даже [предполагаю] кетоны + периодическое голодание (аутофагия).
Чуть меньше информации о пользе кетогенной диеты при инсульте, травмах мозга, боковом амилоидном склерозе, болезни Гентингтона, болезни Паркинсона, рассеянном склерозе.
Эффекты кетогенной диеты на ЦНС представлены на рисунке ниже и в выводах.
Выводы:
- Кетоны начинают синтезироваться, когда концентрация ацетил кофермента А превышает возможности цикла Кребса его переработать;
- Сначала синтезируется ацетоацетат, затем из него получаются бета-гидроксибутират и ацетон;
- Ацетон перерабатывается печенью или выходит через дыхательные пути, в кето-диете и во время голодания его концентрация не достигает значимых уровней;
- Кетоны в организме создают гепатоциты и астроциты;
- Гепатоциты печени производят кетоны, но сами не могут их потреблять;
- Кетоны подавляют метаболизм глюкозы, дают субстрат для каскадных реакций цикла Кребса, способствуют повышению уровней нейтротрасмиттеров GABA и ацетилхолин;
- Кетогенная диета способствует экспрессии термогенина и бурению жира;
- Кето-диета обладает нейрозащитным эффектом и повышает уровень антиоксиданта глутатиона;
- Изначальное увеличение реактивных видов кислорода и водорода на кето-диете приводит к защитной реакции организма, которая заметно снижает оксидативный стресс;
- Кетогенная диета повышает общую массу митохондрий по крайней мере в некоторых отделах мозга, но не очень ясно за счет чего (митохондрии дольше живут и меньше «болеют» или их становится больше итд);
- Кетоны через ацетилирование гистонов влияют на экспрессию генов ДНК; в частности усиливают экспрессию FOXO3 (борьба с опухолями) и супероксид дисмутазу;
- Кетогенная диета обладает противовоспалительным и анти-стрессовым эффектом;
- Кето-диета усиливает экспрессию нейротрофического фактора мозга, что способствует здоровым нейронам со здоровыми связями;
- Материнское молоко кетогенное, и кетоны играют важную роль в нормальном развитии мозга;
- Кетогенная диета может быть полезная для целого ряда нейродегенеративных заболеваний.