Мочевая кислота – продукт метаболизма пуриновых нуклеиновых кислот. У кето-общественности есть озадаченность в связи с ростом мочевой кислоты на кето. Что и является поводом для написания этой заметки.
Очень прошу не путать метаболизм мочевины (urea) и метаболизм мочевой кислоты (uric acid). Мочевина – способ выводить побочные продукты метаболизма аминокислот и важный компонент гомеостаза почек. Не смотря на созвучие и родственную связь, роль молекул очень сильно разнится. Классический пример спутывания теплого с мягким.

Существует 2 разновидности нуклеиновых кислот (структурных компонентов ДНК):
- Пурины: аденин, гуанин;
- Пиримидины: тимин, цитозин
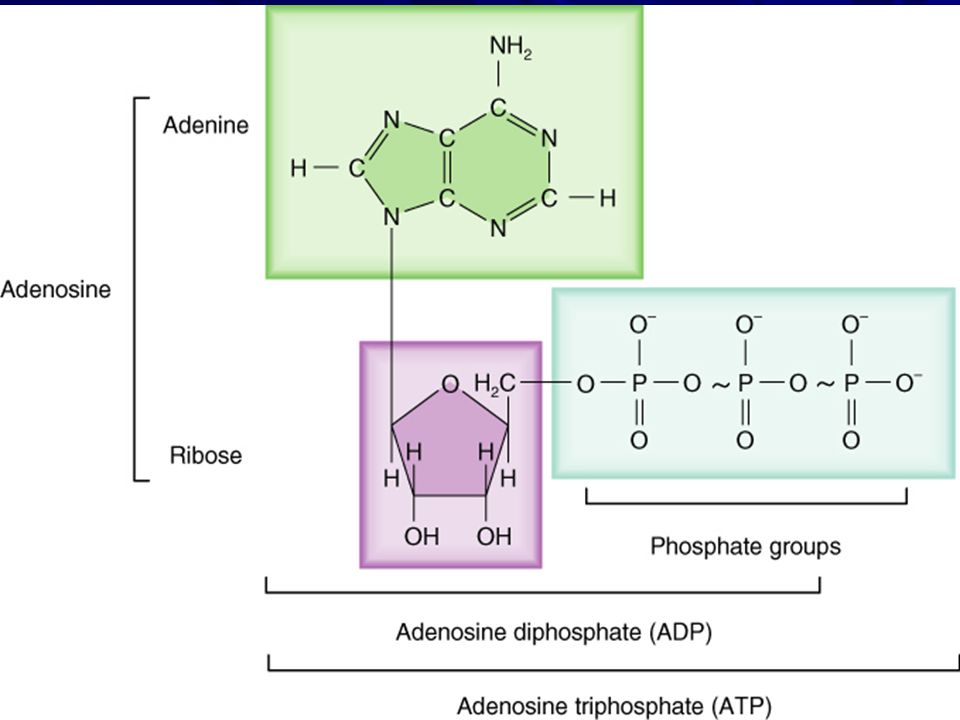
Аденин + рибота + фосфатные группы – это АМФ, АДФ, АТФ, которые представлении не нуждаются.
Кето-диета тут вот причем (к сожалению, будет только база и ничего нового):
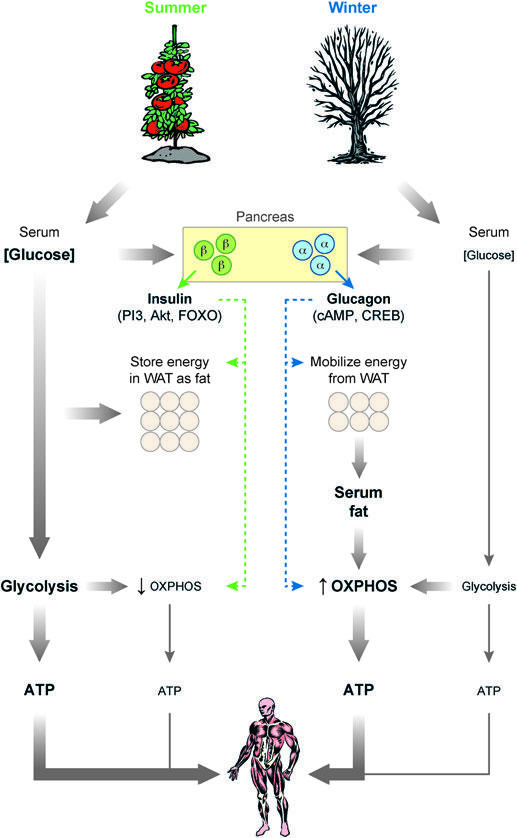
Жиры – более восстановленная форма углерода, чем углеводы. Жировые кислоты можно сильнее окислить и извлечь больше энергии, но с большими затратами кислорода. Жиры – прекрасный способ запасть энергию, потому что их хранения не нужна вода (в отличие от гликогена). Очевидные недостатки жиры: создают проблему большего количества кислородных радикалов (именно поэтому длинноцепочные жировые кислоты укорачиваются в отдельных органеллах пероксисомах до попадания в митохондрии). И куда меньшая универсальность углеродной основы жиров по сравнению с глюкозой. Жиры могут быть запасены, могут отправиться в цикл Кребса и всё. Напрямую восстанавливать пируват или быть сырьем для нуклеиновых кислот они, в отличие от глюкозы, не могут.
Углеводы обладают своими достоинствами и недостатками, которые мы уже разбирали на примере глюкозы и мозга.
Возвращаясь к мочевой кислоте, жиры/кетоны – это больше АТФ на 1 атом углерода и больше реактивных видов кислорода.
АТФ (и ГТФ, получаемый в ходе цикла Кребса), как я вам напомнил, источники пуринов: аденина и гуанина.
Метаболизм на основе жиров/кетонов – больше АТФ/ГТФ – больше пуринов – больше мочевой кислоты [1, 2].
То есть на кето априори растет уровень мочевой кислоты.
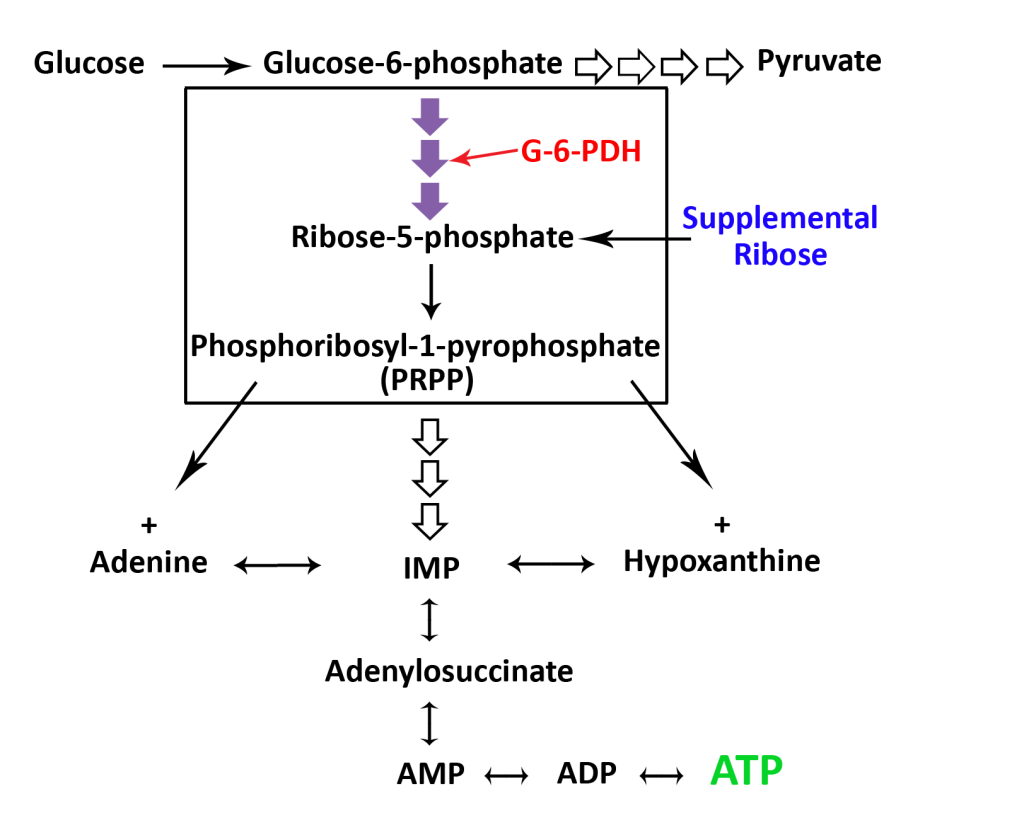
Добивая эту тему, хочу напомнить, что кетоны – слабые кислоты, они снижают pH относительно оптимальных физиологических значений. Окисление мочевой кислоты катализирует фермент уриказа (см рисунок выше). pH меняет конформацию белков, более низкий pH – более закрытая конформация белков/ферментов.
Кетоны как слабые кислоты могут угнетать функцию уриказы, окисляющей мочевую кислоту, за счет снижения pH и смены ее конформации [3].
И также довольно базовый механизм биохимической негативной регуляции – ксантин подавляет активность уриказы [4, 5] (см рисунок выше).
Мочевая кислота как мощный антиоксидант
Рост мочевой кислоты на кето – совсем не повод искать у себя симптомы подагры.
Подагра – тяжелая болезнь, связанная накопление в тканях (первую очередь суставах) мочевой кислоты. В моем понимании, это в основном генетическая болезнь, связанная с патогенными вариациями генов, кодирующих уриказу. Я предлагаю исходить из того, что мы говорим о физиологической норме и рассуждаем о потенциальных причинах, механизмах, плюсах и минусах роста молочной кислоты на кето.
Для наступления просветления в отдельно взятой теме я рекомендую статью Бенхарда Беккера «О физиологической роли мочевой кислоты» далекого 1993-го года [если вы мне напишете, я, конечно же, ни за что вам не вышлю полный текст статьи в pdf ;)].
Беккер напоминает нам, что у большинства млекопитающих основные метаболиты пуринов в крови – это аллантоин и мочевина. И что их уровни мочевой кислоты меньше 10% человеческого уровня. Что уже ставит вопрос: это случайная генетическая вариация, которая нас не убила, или всё же у повышенной концентрации мочевой кислоты есть свои плюсы?
Основной аргумент статьи Беккера, который он умело доказывает, что мочевая кислота и ураты (ее соли) – мощные антиоксиданты.
Мочевая кислота ответственна за нейтрализацию 30-65% всех пероксильных радикалов плазмы. Причем мочевая кислота и ураты находятся как в плазме, так и внутриклеточно, что говорит об их универсальности. Более чем уместно будет ставить ее в один ряд с глутатионом и супероксид дисмутазой.
Помните, что я писал о жирах и кислороде чуть выше? Сжигание жиров – больше кислорода. Больше кислорода – больше кислородных радикалов. Хорошо ли при повышенных кислородных радикалах (повышение которых в митохондриях профильных нейронов гипоталамуса, к слову, дает нам чувство сытости на кето) иметь повышенные уровни антиоксиданта для баланса? Я думаю, что неплохо.
Мочевая кислота как предмет обеспокоенности
Мое мнение, что повышение мочевой кислоты на кето – это нормальный физиологический механизм, имеющий свои очевидные преимущества. Если ничего не беспокоит, то об этом не стоит думать.
В крови сильно повышена мочевая кислота (особенно у полных людей [7]) и есть симптомы, которые (как вам кажется) похожи на подагру. Вы идете к врачу. Врач при виде анализа мочевой кислоты подумает о камнях в почках (тот вид, где мочевая кислота есть) и подарге. Если скажете «кето», то вполне возможно посмотрит на вас, как на идиота. И вам врач выпишет вам симптоматическое лечение (допустим, НСПВП), диету с низким количеством пуринов и аллопуринол или подобный препарат. Ничего из этого не сделает вам здоровее.
Тут я вам хочу напомнить про фармакогенетику. Генотип HLA-B*58:01 будет иметь острую аллергическую реакцию на аллоупуринол [8], которая называется синдром Стивена-Джонсона (Steven-Johnson syndrome) и 10% шанс «сыграть в ящик».
Другие лекарства от подагры обладают не меньшими побочными эффектами. Этот риск оправдан и отчасти необходим больным с подагрой, и совершенно не оправдан для начинающего кетогенщика с болью в суставах (которые не факт, что вызваны мочевой кислотой).
И для душевного успокоения и снижения мочевой кислоты у нас с вами есть натуральные средства (еда и травки):
- Аюрведические (бибхитаки) [9];
- Будничные (вишня) [10];
- И даже немного гурманские (грибы-вешенки) [11].
Pubmed, как говорится, в помощь. Да и кето – сезонная диета, со своими недостатками. В которой, на мой взгляд, не нужно находиться круглый год.
Выводы:
- Мочевая кислота растет на кето из-за:
- Большего количества АТФ/ГТФ на кето;
- Снижения активности уриказы, окисляющей мочевую кислоту, из пониженного кетонами pH;
- Ксантин в рамках биохимической негативной регуляции подавляет активность уриказы;
- Мочевая кислота – мощнейший экстраклеточный и клеточный антиоксидант, помогающий нейтрализовать кислородные радикалы, неизбежно повышающиеся на кето.
- Аллопуринол вне диагностированной подагры (а иногда с ней) – не самая лучшая идея в виду 10% получения мощной аллергической реакции и 1% шанса умереть;
- К другим лекарствам от подагры (фебуксостат, пробенецид) это предостережение относится не меньше;
- В отсутствии симптомов, однозначно связываемых только с мочевой кислотой (профильные камни в почках, явные отложения в суставах итд) про повышенный анализ в крови можно забыть.
- При желании контролировать концентрацию мочевой кислоты рекомендую начать с натуральных продуктов, которые имеют свойство понижать ее уровень.
Источники
- Uric Acid Excretion and Ketosis in Fasting;
- Purines and the Anti-Epileptic Actions of Ketogenic Diets
- Effect of pH on uricase activity
- THE INHIBITION OF URICASE BY XANTHINE
- Regulation of uric acid metabolism and excretion;
- Towards the physiological function of uric acid;
- Uric acid secretion from adipose tissue and its increase in obesity
- Allopurinol Therapy and HLA-B*58:01 Genotype;
- A randomized, double-blind, placebo-, and positive-controlled clinical pilot study to evaluate the efficacy and tolerability of standardized aqueous extracts of Terminalia chebula and Terminalia bellerica in subjects with hyperuricemia; – бибхитаки
- Cherry Consumption and the Risk of Recurrent Gout Attacks
- Characterization of an Anti-gout Xanthine Oxidase Inhibitor from Pleurotus ostreatus – вешенки;

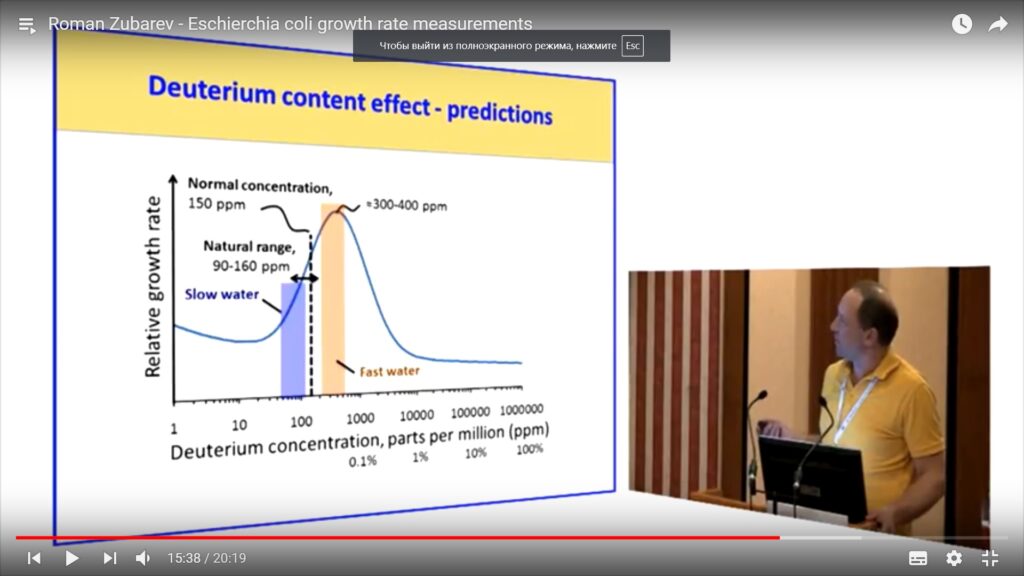
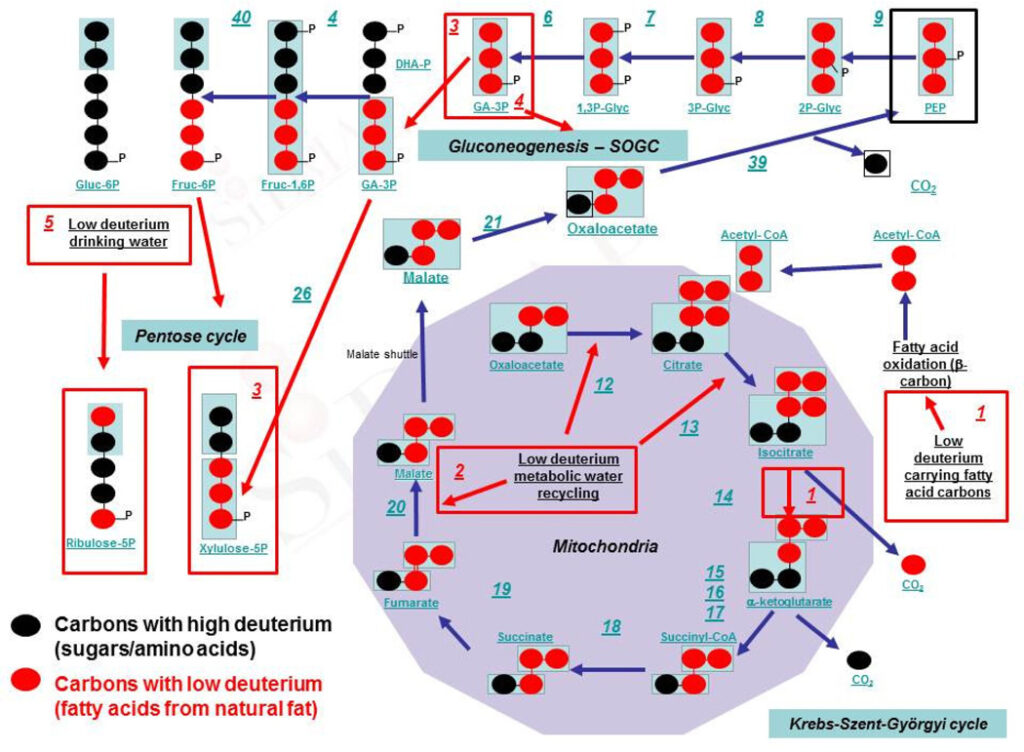
 Дейтерий обладает большей массой и иным спином, чем традиционный водород, поэтому вода, где вместо водорода у нас дейтерий связан с кислородом, будет отличаться по своим физических характеристикам.
Дейтерий обладает большей массой и иным спином, чем традиционный водород, поэтому вода, где вместо водорода у нас дейтерий связан с кислородом, будет отличаться по своим физических характеристикам.